Darstellung von Essigsäureethylester
aus Ethanol und Acetanhydrid
in geschlossener Apparatur
Inhalt:
1. Kurzbeschreibung des Sachzusammenhanges
2. Experiment
3. Chemikalien und Sicherheitshinweise
4. Aufbau und Beladung mit Chemikalien
5. Durchführung und Beobachtung
6. Auswertung, Ergebnis, Folgerungen, Ausblick
Die Reaktion von Alkohol mit Carbonsäure ist eine sehr wichtige chemische Reaktion in der organischen Synthese und Biochemie. Die sogenannter Veresterung wird deshalb im Chemieunterricht das Experiment mit Ethanol und Essigsäure in einer einseitig offenen Apparatur (ohne Abzug) durchgeführt. Dabei wird der Essigsäureethylester gebildet, der Schülerinnen und Schülern vom Geruch her als Lösemittel für z.B. Nagellack oder Klebstoffen bekannt ist.
Das Experiment wird gemeinhin als gering gefährdend eingestuft und wird daher gern in Schülerübungen durchgeführt. Die auftretenden Edukte und Produkte gelten als nur gering gefährlich. Auch die zur Katalyse verwendete konzentierte Schwefelsäure wird wegen seiner großen Verdünnung nicht als bedeutende Gefährdung angesehen. Das Experiment ist jedoch durch auftretende und nachweisbare Zwischenprodukte (hier Diethylsulfat ![]() Gestis-Stoffdatenbank) mit einer deutlichen Gefährdung verbunden. Aus Unwissenheit wird jedoch das Experiment weiterhin in einer einseitig offenen Apparatur durchgeführt. - Hier zeigt sich an einem relativ harmlosen Experiment der organischen Chemie, dass mit unbekannten Stoffen umgegangen werden muss wie mit Gefahrstoffen. Es ist jedoch das Arbeiten in einer geschlossenen Apparatur (Gefahrstoffverordnung, Schutzstufe 3; RiSU) nötig.
Gestis-Stoffdatenbank) mit einer deutlichen Gefährdung verbunden. Aus Unwissenheit wird jedoch das Experiment weiterhin in einer einseitig offenen Apparatur durchgeführt. - Hier zeigt sich an einem relativ harmlosen Experiment der organischen Chemie, dass mit unbekannten Stoffen umgegangen werden muss wie mit Gefahrstoffen. Es ist jedoch das Arbeiten in einer geschlossenen Apparatur (Gefahrstoffverordnung, Schutzstufe 3; RiSU) nötig.
Die Produkte Essigsäureethylester und Ethanol haben nahezu gleiche Siedetemperatur (Sdt=76°-78°C). Daher ist Ein Überschuss an Ethanol bei der Synthese zu vermeiden. Da aber Essigsäure keinen vollständigen Stoffumsatz erwarten läßt, ist die Verwendung von effektiveren Acetylierungsmiteln (hier Essigsäureanhydrid im Überschuss) vorteilhaft. Noch stärkere Acetylierungsmittel (z.B. Acetylchlorid) sollten wegen der gleichsinnig anwachsenden Gefährdung nicht anzuraten. Link zu den Gefahrstoffdaten der Gestis-Stoffdatenbank ![]() ;
;
2. Experiment
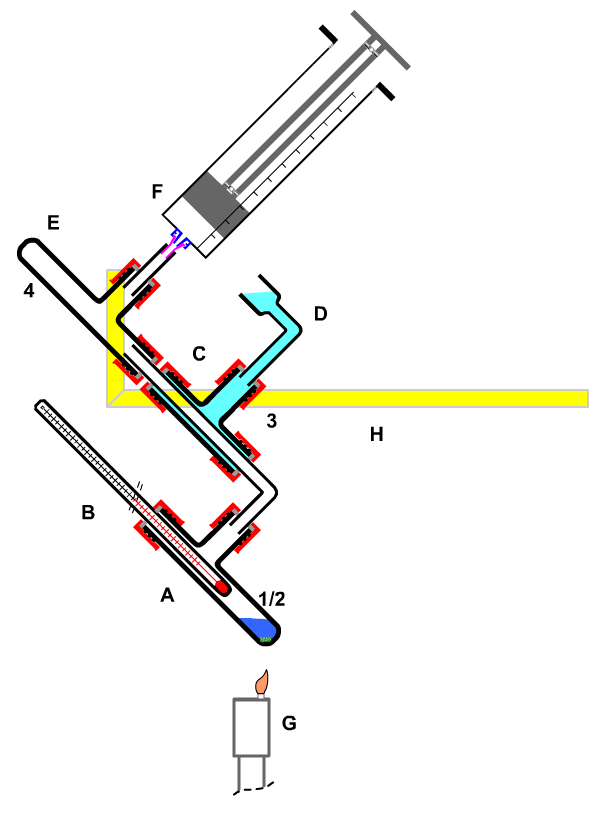
A Reaktionsgefäß G Heizung Kerzenflamme H Stativ alternativ: 1 Essigsäurenhydrid Hilfsmittel: Siedestein!! |
|
| Bild 1: Siedetemperaturbestimmung von Essigsäureanhydrid |
Essigsäure ![]() Gestis-Stoffdatenbank ;
Gestis-Stoffdatenbank ;
Ethanol ![]() Gestis-Stoffdatenbank;
Gestis-Stoffdatenbank;
Essigsäureethylester ![]() Gestis-Stoffdatenbank;
Gestis-Stoffdatenbank;
Essigsäuranhydrid ![]() Gestis-Stoffdatenbank;
Gestis-Stoffdatenbank;
Schwefelsäure ![]() Gestis-Stoffdatenbank;
Gestis-Stoffdatenbank;
Natronlauge ![]() Gestis-Stoffdatenbank;
Gestis-Stoffdatenbank;
Acetylchlorid ![]() Gestis-Stoffdatenbank;
Gestis-Stoffdatenbank;
Diethylsulfat ![]() Gestis-Stoffdatenbank;
Gestis-Stoffdatenbank;
A Destillationsgefäß F Heizung: Sparflamme Hilfsmittel: neuer Siedestein!! Bild: Destillation mit elektrischer Heizung |
|
Bild 2: Destillieren in geschlossener Apparatur; Destillieren mit Unterdruck |
Die zusammengesetzte Apparatur muss im leeren Zustand auf Dichtigkeit geprüft werden. Man zieht dazu mit dem Kolbenprober eine Vakuum und hält dieses ca. 20 Sekunden. Dabei zieht sich der Gummisauger zusammen. Nach dem Entlasten muss ein leicht beweglicher Kolben wieder bis auf ca. 5 ml wieder in den Zylinder hineingezogen werden, wobei der Gummisauger immer noch einen leichten Unterdruck anzeigt. Schiebt man den Kolbenprober ganz hinein, so ist der Gummisauger wieder im Anfangszustand. Er soll sich aber dabei noch weich anfühlen. Ist er strammt gefüllt, hat die Apparatur über eine undichte Stelle etwas Luft gezogen. Erst nach einer gelungenen Funktionsprüfung kann die Apparatur mit Chemikalien befüllt werden.
Persönliche Schutzausrüstung: Schutzbrille, Schutzhandschuhe, Arbeitskittel
Chemikalien: alle Angaben sind als ungefähre Maßangaben anzusehen.
Gefahrstoffdaten sind im Internet mit der Gestis-Datenbank![]() zu aktualisieren.
zu aktualisieren.
Entsorgung:
Nach dem Experiment befinden sich noch erhebliche Anteile von Chlor in der Apparatur. Bevor die Apparatur geöffnet werden kann, muss die Chlorentwicklung gestoppt werden und gleichzeitig das noch vorhandene Chlor gebunden werden. Das Binden des Chlors kann durch Natronlauge oder Kalilauge oder alternativ durch Natriumthiosulfat in der Gaswaschflaschengruppe E,F geschehen.
Didaktischer Hinweis zum Experiment: Bindet man das Chlor mit verdünnter Kalilauge, so tritt eine Disproportionierung zu Kaliumchlorid und Kaliumhypochlorit mit gleichzeitiger Entfärbung ein. Bewahrt man diese Lösung auf, so kann man später aus dieser Lösung durch Ansäuern mit Salzsäure wieder Chlor (Chlorwasser) herstellen, dass für die Verdrängungsreaktionen von Bromid und Jodid, nicht aber von Fluorid aus ihren Salzen genutzt werden kann. (abgestufte chemische Eigenschaft innerhalb der homologe Reihe Chlor, Brom, Jod)
Benutzt man eine stark alkalisch gemachte Natriumthiosulfat-Lösung, so wird das gesamte Chlor zu Chlorid reduziert und dar eventuell entstehende Schwefeldioxid (T; R:23-34, S: 9-26/-36-37-39-45) als Sulfit gebunden. Reste von Schwefeldioxid verbleiben in der Gasphase, weshalb die Apparatur unter dem Abzug geöffnet werden muss. Will man auch das Sulfit noch entgiften, so muss die Entsorgungslösung von mit verdünnter Wasserstoffperoxid-Lösung versetzt werden wobei das Sulfit zu Sulfat oxidiert wird. Geringe Mengen überschüssigen Wasserstoffperoxids kann man mit einer Eisen(II)-Lösung reduzieren. Diese Lösung kann ins Abwasser gegeben werden. Durch die Verwendug sehr kleiner Stoffportionen in der Halbmikrotechnik kann jedoch schon die wässrige Lösung des Chlors ins Abwasser gegeben werden. Üblicherweise wird so auch Badewasser in Freibädern gechlort und damit schwach biozid gehalten.
Zur Vorbereitung des Öffnens der Apparatur zieht man mit dem Kolbenprober ein leichtes Vakuum und öffnet dabei die Apparatur durch Entfernen des Gummisaugers. Sofort tritt etwas Luft ein und verhindert so das Austreten von Chlor über den Tropfer. Nun füllt man nach und nach den Tropfer mit verdünnter Natronlauge und saugt die Lösung durch die saure Calciumhypochlorit-Lösung. Mit fortschreitender Zugabe von Natronlauge verschwindet die gelbe Farbe des Chlors aus der Lösung wegen der Reaktion mit der Natronlauge zu Natriumhypochlorit und Natriumchlorid (Disproportionierung).
Aufbau:
Die Apparatur besteht aus einem Gasentwickler (A), der durch eine Wasserfalle (B) vom Reaktionsrohr (C) (Borosilikatglas) getrennt ist. Überschüssige Gase werden nach Passieren des Reaktionsrohres (D) und einer Sicherheitsflasche(E) in der Gaswaschflasche (F) absorbiert. Nicht absorbierte Bestandteile werden als Restgas in einen Kolbenprober (H) aufgefangen. Der Dreiwegehahn (G) dient der Be- und Entlüftung.
Die Apparatur wird zuerst komplett liegend auf dem Tisch zusammengebaut. Anschließend wird die gesamte Apparatur von der Rückseite her mit Federklammern (runde Kunststoffseite) versehen. In die Stahlseiten der Federklammern wird das Alu-Vierkantrohr eingelegt bis die Federklammern einrasten. Dabei soll das Glührohr frei zwischen den Alu- Vierkantrohren hängen, damit es dort problemlos mit dem Gasbrenner erhitzt werden kann.
Die Apparatur wird im leeren Zustand auf Dichtigkeit geprüft (siehe Abschnitt 2. Experiment Funktionsprüfung).
Beladen der Apparatur
Danach erfolgt das Beladen Apparatur mit Chemikalien. Das geschieht in aufsteigender Reihenfolge der Gefährdung: man füllt erst die ungiftigen und unbeweglichen Stoffe ein (z.B. Feststoffe in tiefliegenden Gefäßen, Entsorgungsmittel). Anschließend geht man zu den gefährlicheren und leichter beweglichen Stoffen über. Im konkreten Fall ist die Reihenfolge:
- Natriumthiosulfat einfüllen (4, F)
- Calciumhypochlorit einfüllen (2, A)
- [Soll auch die "Giftwirkung" von Chlor demonstriert werden: Die Wasserfalle (B) mit dem Verschlussstück nach oben drehen, dann rote Blütenblätter, schwarze feuchte Haare oder ein Blatt Papier mit frischer königsblauer Tinte geben, zuletzt ist die Wasserfalle wieder zu verschließen und das Ansatzstück nach unten drehen.]
- Natrium in zwei Portionen mit ca. 1cm Abstand in das Reaktionsrohr (3, C) geben. Die Natriumstücke dürfen nicht so groß sein, dass sie im geschmolzenen Zustand das Reaktionrohr verschließen.
- halbkonzentrierte Salzsäure mit dem Tropfer (1, A) aufnehmen, an der Schraubkappe gehalten in den Gasentwickler (2, A) einsetzen und fest verschrauben.
Verdünnte Natronlauge wird bereithalten, um bei einer Störung während des Experimentes und nach dem Experiment (Entsorgung) die weitere Chlorentwicklung zu unterbrechen.
A Destillationsgefäß F Heizung: Sparflamme Hilfsmittel: neuer Siedestein!! Bild: Destillation mit elektrischer Heizung |
|
Bild 2: Destillieren in geschlossener Apparatur; Destillieren mit Unterdruck |
Auswertung:
Ergebnis:
Folgerung:
Ausblick:
Diese halbmikrotechnische Apparatur gestattet es, chemische Reaktionen mit hochgiftigen Gasen und äußerst reaktiven Stoffen durchzuführen. Die Verwendung der Halbmikrotechnik minimiert die verwendeten Stoffportionen und reduziert damit die Gefährdung und die Kosten für Einkauf, Lagerung und Entsorgung. Durch Verwenden einer geschlossenen Apparatur wird eine Entsorgung der Gefahrstoffe in der Apparatur möglich. Insgesamt werden so die Bedingungen für einen sicheren uns sachgerechten Umgang mit Chemikalien eingehalten.
Eine Zusammenfassung über die apparativen Methoden, findet sich hier ![]() .
.
Blume-Chemie: http://www.chemieunterricht.de/dc2/tip/04_00.htm ![]()
Copyright 2005-2015 HMTC Halbmikrotechnik Chemie GmbH; www.halbmikrotechnik.de