|
"Von der Natriumchlorid-Synthese zu den Grundlagen des apparativ-chemischen Denkens" - Induktive Denkweise |
|
Übersicht
|
||||||||||||||||||
0. Didaktische Anmerkungen für den Workshop Anhand der Natriumchlorid-Synthese aus den Elementen soll exemplarisch die Arbeits- und Denkweise in der Chemie aufgezeigt werden. Die Reaktion von Natrium mit Chlor ist eine sehr wichtige chemische Reaktion auf dem Wege zum Verständnis der chemischen Bindung. Das Experiment wird mit gefährlichen Stoffen durchgeführt. Dabei stellen sowohl das giftige, gasförmige Chlor als auch das reaktive Element Natrium große Risikofaktoren dar. (Chlor
| ||||||||||||||||||
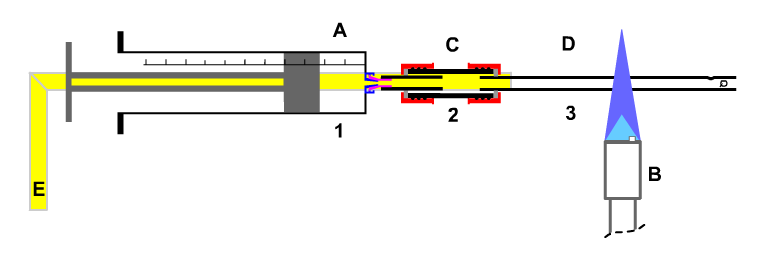
1. Das Experiment Bild 1: Die Darstellung von Natriumchlorid aus den Elementen mit der Halbmikrotechnik in geschlossener Apparatur. - Entsorgung der Gefahrstoffe in der Apparatur, ohne die Apparatur zu öffnen.
|
||||||||||||||||||
2. Systematischer schrittweiser Aufbau der Apparatur aus halbmikrotechnischen Geräten Ausführliche Versuchsanleitung Kurzfassung für die "Lehrerübung" Auszug für den Zusammenbau:
|
||||||||||||||||||
Durchführung (extrem stark gekürzt):
Ausführliche Versuchsanleitung
Beladen Sie nun die Apparatur und beginnen Sie mit der Natriumthiosulfat-Lösung (4 in E. Danach füllen Sie eine erbsengroße Portion Calciumhydroxid (1 in A) ein. Nun schneiden Sie sich zwei streichholzkopf-große Stücke aus dem Natrium-Vorrat, drücken diese zu zwei länglichen Rollen und legen sie in die Mitte des Reaktionsrohres (3 in C) im Abstand von ca. 2 cm.
|
||||||||||||||||||
3. Abstraktion der Apparatur auf allgemeine Konstruktionsweisen; Chemische Operationen und Methoden Um eine Apparatur zu konstruieren, geht man von den Aggregatzuständen der Edukte und erwarteten Produkte aus und kombiniert diese mit den Reaktionsbedingungen. Durch die Gefährlichkeit der Stoffe wird die Schutzstufe (Gefahrstoffverordnung) im Umgang mit den Stoffen bestimmt. Zur Vereinigung der Edukte und zum Auftrennen eines Produktgemisches haben sich spezielle Operationen herausgebildet. Dazu müssen Stoffe transportiert werden. Für die Edukte gilt: "Der leichter bewegliche Aggregatzustand wird zum schwerer beweglichen hin bewegt." Für die Produkte gilt: "Der schwer bewegliche Aggregatzustand wird zuerst aus dem Stoffgemisch entfernt". Die Größe der Apparaturen hängt davon ab, wie viel Ausgangssubstanz vorhanden ist oder wie viel Produkt benötigt wird. Für analytische Zwecke werden möglichst kleine Stoffportionen eingesetzt. Hier werden physikalische Methoden, die eine Weiterverwendung der Stoffe nach der Untersuchung zulassen, den chemischen Methoden vorgezogen, da diese immer mit einer Stoffumsetzung verbunden sind. Im vorliegenden Fall ist die der Einsatz einer Apparatur der Schutzstufe 3 zwingend erforderlich, da während des Experiments gasförmiges Chlor freigesetzt wird. Die chemischen Reaktionen im Einzelnen:
|
||||||||||||||||||
4. Durchführung und "gute Laborpraxis"
Redundante Sicherheitsmaßnahmen Die Grundregel der chemischen Reaktion lautet: "Stoffe können nur dann miteinander reagieren, wenn sie sich berühren". Um also chemische Reaktionen am Menschen zu vermeiden, dürfen Chemikalien nicht mit dem Menschen dem Menschen in Kontakt kommen. Dazu dienen die persönlichen Schutzmaßnahmen, Schutzbrille, Handschuhe und Brille. Sie sind allesamt redundante Sicherheitsmaßnahmen. Die primäre Schutzmaßnahme ist die geschlossene Apparatur. - Eine geschlossenen Apparatur muss aber auch befüllt und entleert werden. Damit dabei aber keine gesundheitsgefährdenden oder giftigen Stoffe frei werden, wird ein Abzug benötigt. Apparative Maßnahmen Für die Konstruktion einer chemischen Apparatur gilt Die Grundregel der Stofftrennung. Die Grundregel lautet: "Stoffe mit unterschiedlichem Reaktionsverhalten müssen vor unbeabsichtigtem Kontakt durch Puffervolumina getrennt sein". Selbstverständlich müssen die bereitgestellten Puffervolumen so beschaffen sein, dass sie die eventuell übertretenden Stoffportionen vollständig aufnehmen können. Außerdem sollte eine Apparatur so geplant sein, dass die darin ablaufende Reaktion schnell abgebrochen werden kann. Chemische Reaktionen sollten auch nicht unbeaufsichtigt betrieben werden. Operative Maßnahmen Zu allen chemischen Reaktionen und Reaktionsbedingungen, die in einer Apparatur ablaufen, sind "Antagonisten" bereitzuhalten, um eine Reaktion zu stoppen. Wird während des Experiments erhitzt, so sind Notkühlungen zu planen, wird bei einer Reaktion ein Gas frei, so sind Ausweichvolumen vorzuhalten. Beim Entstehen von Säuren sind Laugen und umgekehrt bereitzustellen usw. Wird die chemische Reaktion von einer Person durchgeführt, so ist sie so zu planen, dass sie notfalls mit einer Hand bedient werden kann. Die zweite Hand ist für für das Eingreifen im Notfall als redundante Sicherheitsmaßnahme gedacht. - Allein Arbeitende sollten im Notfall Hilfe herbeirufen Können. Bei allen Arbeiten in einem Labor, wo es prinzipiell darum geht, Unbekanntes zu erforschen bleibt ein Restrisiko. Unter dem Risiko versteht man das Produkt aus dem Grad der Gefährdung und der Wahrscheinlichkeit des Eintretens. Das verbleibende Restrisiko ist zu minimieren, wobei zu beachten ist, dass zu viele Sicherheitsmaßnahmen eine Steigerung der Gefährdung hervorrufen können. Nur wenn man gewillt ist, die Forschung ganz einzustellen, kann man das Forschungsrisiko auf "Null" drücken.
|
||||||||||||||||||
5. Apparative Reduktion Diese spezielle Apparatur ist geeignet für alle Chlorierungen.
|
||||||||||||||||||
5a. alternative Apparatur ohne Gasabsorption Wenn nicht mit so giftigen Gasen gearbeitet werden muss, kann die Entsorgungseinheit (D, E aus Bild 3) ersetzt werden. Oft reicht es, das Restgas durch Luft zu verdrängen und in einem Kolbenprober aufzufangen. Diese beiden Apparaturen können benutzt werden, um die unterschiedliche Reaktionsweise von Eisen mit Chlor (Experimentskizze Bild 2) und mit Chlorwasserstoff (Experimentskizze Bild 5). Mit Chlor reagiert Eisen gemäß: 3 Cl2,g + 2 Fe,s --> 2 FeCl3,s (Anmerkung: Redoxreaktion mit elementarem Chlor!), mit Chlorwasserstoff reagiert Eisen gemäß: 2 HCl,g + Fe,s --> 2 FeCl2,s (Anmerkung: Redoxreaktion mit Wasserstoff!). Versuche und Nachweise der verschiedenen Oxidationsstufen des Eisens veröffentlicht in der Praxis der Chemie 8/1991
|
||||||||||||||||||
5b. Teiloperationen Die Ausgangsapparatur besteht aus vier chemischen Operationen. Die einzelnen Operationen sind durch Puffervolumen getrennt.
Zerlegt man die Apparaturen noch weiter, so findet man folgende Grundoperationen, die noch durch weitere häufig benötigte Operationen ergänzt werden.
|
||||||||||||||||||
|
|
6. Schematische
Gliederung von Apparaturen
|
|||||||||||||||||
7. Apparaturen Die einfachsten Apparaturen ergeben sich, wenn ungiftige Gase als Edukte oder Produkte entstehen. Eine häufige Reaktion ist die Umsetzung eines Feststoffes mit Luft. z.B.: Luft reagiert mit Eisenwolle zu Eisenoxid; Aggregatzustand/Bedingung: Luft,g + Fe,s --> ca. 600°C --> FeO,s. Apparatur: Reaktionsrohr (Quarzglas) + Kolbenprober (Sog) oder Kolbenprober (Druck) + Reaktionsrohr (Quarzglas)
Will man die quantitative Bestimmung des Anteils Sauerstoff in der Luft bestimmen, so kombiniert man beide Apparaturen zu einer geschlossenen Apparatur. Um die bei die Volumenverringerung zu bestimmen, muss die Ablesung der Volumina in den Kolbenprobern bei gleichem Druck geschehen. Dazu wird eine Apparatur ergänzt mit einer Tauchung zur Einstellung des drucklosen Zustands .
Wenn man zur Tauchung noch einen Zugang hinzufügt, können auch quantitative Umsetzungen mit anderen Gasen untersucht werden. So kann z.B. in einer ersten Reaktion Kupfer mit 100 mL Luft oxidiert werden. Danach wird der verbliebene Luftrest durch Wasserstoff ersetzt. In einer zweiten Reaktion wird dann mit das aus der Reaktion mit 100mL Luft gebildete Kupferoxid mit Wasserstoff reduziert. Aus dem Verbrauch kann man Hinweise auf die Summenformel von Wasser ziehen (der Satz von Avogadro ist dazu Voraussetzung.) Wasserstoff reagiert mit Kupferoxid zu Kupfer und Wasser; Aggregatzustand/Bedingung: Wasserstoff,g + CuO,s --> ca. 600°C --> Cu,s + H2O,(l) Apparatur: Reaktionsrohr (Quarzglas) + Kolbenprober (Sog) oder Kolbenprober (Druck) + Reaktionsrohr (Quarzglas) Das Prinzip, aus den Aggregatzuständen der Stoffe die notwendigen Operationen abzuleiten und diese zu chemischen Apparaturen zusammenzufügen, kann recht komplexe Apparaturen hervorbringen. Nachstehend wird eine Apparatur gezeigt, mit der die Einstellung des Bouduoard-Gleichgewichte Dazu wird in zwei Schritten zuerst Kohlenstoff mit Kohlenstoffdioxid zur Reaktion gebracht und die Volumenzunahme durch Bildungdes Kohlenstoffmonoxids bestimmt. Zu Kontrolle wird aus dem entstandenen Gasgemisch das verbliebene Kohlenstoffdioxid mit Kalilauge absorbiert und die Volumenverminderung bestimmt. Zuletzt kann noch die Massenabnahme des eingesetzten Kohlenstoff bestimmt werden, was wegen der geringen Massen eine sorgfältige Trocknung des einsetzten Kohlenstoffs (Zeichenkohle der Firma Faber-Castell) und eine Analysenwaage voraussetzt. Die Apparatur hierzu ist in Bild zu sehen.
Eine Aufstellung über die Möglichkeiten, im Labor Gase herzustellen, findet man u.a. bei Th. Seilnacht
|
||||||||||||||||||
Bild 1: Die Darstellung von Natriumchlorid aus den Elementen mit der Halbmikrotechnik in geschlossener Apparatur. Bild 2: Natriumchlorid-Synthese aus den Elementen mit Entsorgung Bild 3: Natriumchlorid-Synthese aus den Elementen mit Entsorgung Bild 4: Natriumchlorid-Synthese aus den Elementen mit Auffangen des Restgases Bild 5: Reaktionsrohr (Quarzglas) + Kolbenprober (Sog) Bild 6: Reaktionsrohr (Quarzglas) + Kolbenprober (Druck) Bild 7: Quantitative Gasbestimmung bei der Reaktion eines Feststoffes mit einer Flüssigkeit Bild 8: Reaktionsrohr (Quarzglas,C ) + 2 Kolbenprober (A, E) + Tauchung (D) Bild 9: Teilapparatur A-H: Quantitative Bestimmung der Bildung von Kohlenstiffmonooxid Bild 10: Foto einer Natriumchlorid-Synthese anläßlich einer Lehrerfortbildungsveranstaltung an der Westfälischen-Wilhelms-Universität Münster , Institut der Didaktik der Chemie. (von rechts: Prof. Dr. D. Barke; Prof. Dr. G. Harsch; Dr. K.-G. Häusler)
|