WWU - Didaktik der ChemieChemische Bindung II
|
 |
![]() i
i
![]() Stoffminimierung am Beispiel der Komplexchemie
Stoffminimierung am Beispiel der Komplexchemie
Bei der Vermittlung einfacher Bindungstypen, wie sie bei binären ionischen Verbindungen vorliegen, gilt eine einfache Regel: jedes Element ist bestrebt in Abstimmung mit dem Reaktionspartner eine Elektronenkonfiguration des nächstliegenden Edelgases zu erreichen.
Daneben gilt es auch kompliziertere Verbindungen zu verstehen, die Komplex-Verbindungen. Hier scheinen Verbindungen zu existieren, deren Bindungsregeln den einfachen Reaktionsverläufen widersprechen.
Am Beispiel der Reaktionen von (neutralen) Salzen mit starken Säuren bzw. Basen lassen sich die Säure-Basen-Gleichgewichte erweitern.
Verdrängungsreaktionen, die die Flüchtigkeit eines Stoffes zur Verschiebung einer Gleichgewichtslage nutzen, kann durch den Ammoniak-Nachweis aus organischen Aminen durch Natriumhydroxid deutlich gemacht werden - eine Anwendung des "Ammoniak-Springbrunnens.
Am Beispiel von farbigen Metallsalzen lässt sich die Komplexbildung nachweisen durch Umkehr der Wanderungsrichtung.
Am Beispiel der Substitution von Wasserstoff durch Brom kann eine Verdrängungsreaktion nichtionischen Typs gezeigt werden.
Diese Reaktionen werden in Form von Experimenten zugänglich, die mit minimalen Stoffportionen in geschlossenen Systemen durchgeführt werden.
![]() 2
2
![]() Der Salzsäure-Springbrunnen
Der Salzsäure-Springbrunnen
Schülerinnen und Schüler vermuten im ersten Anlauf, dass Kochsalz (Natriumchlorid) und Schwefelsäure nicht miteinander reagieren, da sie keine entgegengesetzten Eigenschaften besitzen. Kochsalz ist ein Salz, das bei der Neutralisation von Natronlauge mit Salzsäure entsteht, außerdem kommt es natürlicherweise vor, ohne chemische Reaktionen zu zeigen.
Anders ist es mit der Schwefelsäure, diese komm in der Natur nicht in reiner Form vor, sie reagiert in der Regel sofort. Das lässt vermuten, dass Natriumchlorid mit Schwefelsäure reagieren könnte. Die Frage ist, welche Eigenschaft die Reaktionsprodukte besitzen. Diese Frage kann im dem für die Sicherheit wichtigen Teilaspekt von Schülerinnen und Schülern beantwortet werden, obwohl sie innerlich noch gar nicht von einer chemischen Reaktion überzeugt sind.
Welche Eigenschaften können die Stoffe besitzen, so dass sie in einer Gefährdungsanalyse bedacht werden sollten?
Halbmikrochemische Springbrunnen nach K.-G. Häusler
Salzsäure und Ammoniak-Springbrunnen im Vergleich
Salzsäurespringbrunnen nach Th. Seilnacht
![]()
Th. Seilnacht zeigt, wie man mit einer Makroapparatur zunächst Chlorwasserstoff im Abzug erzeugt, anschließend wird im zweiten Teil des Experimentes
Halbmikrochemische Springbrunnen nach microchem
P. Schwarz zeigt, wie man den Stoffeinsatz durch Halbmikrotechnik mit einfachen Mittel minimieren kann und zeigt so die Springbrunnenversuche in einer ungefährlicheren Variante. aber auch hier werden die Versuche als Lehrerversuche eingestuft, weil sie als offene Apparaturen geplant sind.
![]() 3
3
![]() Ammoniak-Nachweis in der Mikrogaskammer
Ammoniak-Nachweis in der Mikrogaskammer
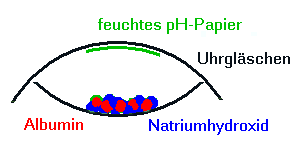
Bild 1: Ammoniak- Nachweis mit der Mikrogaskammer
![]() 4
4
![]() Protolyse von Chlorwasserstoff
Protolyse von Chlorwasserstoff
Leitfähigkeit von Chlorwasserstoff in verschiedenen Lösemitteln (halbmikrochemisch)
Weitere Versuchsliteratur (Uni-Bayreuth,
Chemie-Didaktik, Säure-Basen-Reaktion, Unterrichtsentwurf ![]()
![]() )
)
![]() 5
5
![]() Komplexbildung farbiger Metallsalze und Ionophorese
Komplexbildung farbiger Metallsalze und Ionophorese
Objektträger mit Filterpapier umwickeln. Die Mitte wird mit Bleistift markiert. Das Filterpapier wird mit verdünnter Kaliumnitrat-Lösung angefeuchtet. Die beiden Enden werden mit Bleistift-Minen (Kohle-Elektroden) belegt und mit zwei Krokodilklemmen kontaktiert.
Auf die Mitte des Filterpapiers gibt man einen kleinen Kristall eines farbigen Metallsalzes und elektrolysiert mit Gleichspannung.
Beim Anlegen von Spannung bilden sich farbige
6 Radikalische Substitution von Wasserstoff durch Brom am Heptan (OH-Projektion)
Experimente in Mikrogaskammer
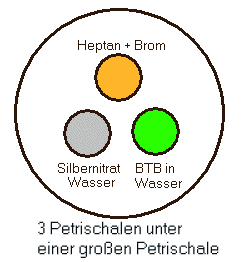
Bild 2: Radikalische Substitution von Wasserstoff durch Brom
uni-saarland
![]() (Die Versuchsbeschreibungen sind nicht auf dem neuesten Sicherheitsstand!! Hier
n-Heptan statt n-Hexan nehmen!)
(Die Versuchsbeschreibungen sind nicht auf dem neuesten Sicherheitsstand!! Hier
n-Heptan statt n-Hexan nehmen!)
Hinweise auf die gesetzlichen Bestimmungen
Chemikaliengesetz ChemG
Gefahrstoffverordnung GefStoffV ( html - Dokument )
SiNTU
© 2001 HMTC
- Halbmikrotechnik Chemie;
Klaus-G.
Häusler
; ![]() haeusler[at]muenster[dot]de
haeusler[at]muenster[dot]de
www.muenster.de/uiw/fach/chemie/institut/wwu/haeusler2/s-std11.htm_18.11.2005 19:57