|
Quantitative Bestimmung von
Schwefel und Halogenen in organischen Verbindungen
|
| Experiment |
Bestimmung von Schwefel und Halogenen mit der modifizierten Schöninger-Methode |
Reaktion: |
C13H12N4S + 34 CuO => 13 CO2 +
6H2O + 2N2 + SO2 Oxidation der
Substanz (S-Best.)
SO2 + H2O2 => SO3 + H2O
Oxidation der Gase
SO3 + H2O => H2SO4
Absorption
SO42- + Ba+ => BaSO4
Fällung Cl-CH2-CH2-Cl + 5CuO => H2O + 2HCl +
2CO2 Oxidation der Substanz (Cl-Best.)
2AgNO3 + K2CrO4 =>
2KNO3 + AgCrO4
AgNO3-Überschuss bei Äquivalenzpunkt
|
Apparatur: |
|
Schwefel/Chlor-Bestimmung
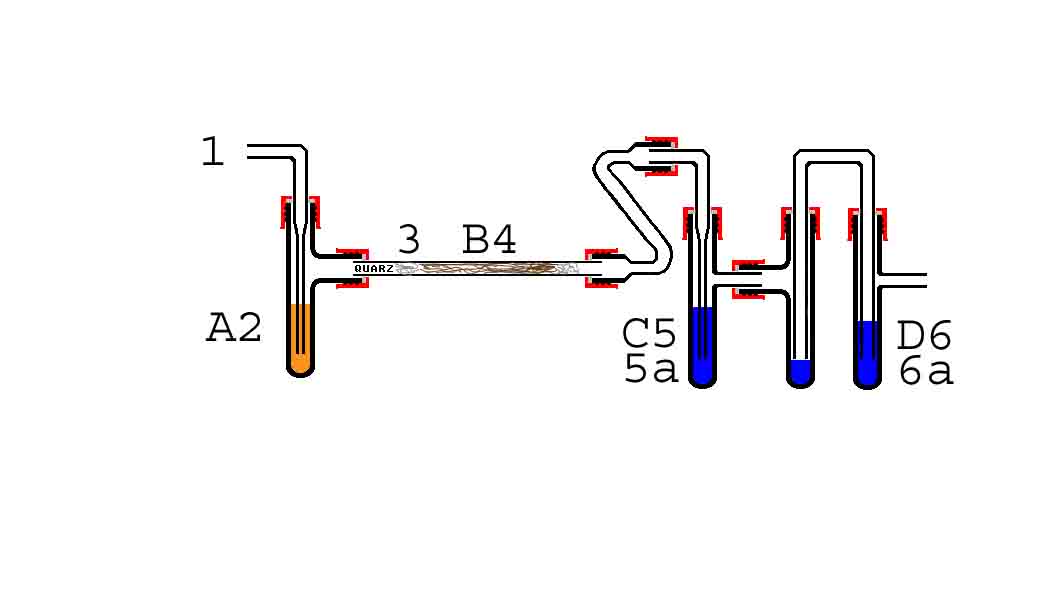
|
A Reinigung
B Quarz-Reaktionsrohr
C Vorabsorption
D Intensiv-Absorption
1 Luft-Zuleitung
2 Eisen(III)-chlorid-Lösung
3 Untersuchungssubstanz
4 Kupfer(II)-oxid
5 Wasserstoffperoxid
5a Wasser
6 Wasserstoffperoxid
6a Wasser
|
|
Stoffe : |
(1) Gasflasche mit Synth.-Luft oder Membranpumpe
(2) 3 mL gesättigte Eisen(III)-chlorid-Lösung (zur Entfernung von Schwefelverbindungen aus
Syn.-Luft oder der Luft)
(3) 2-3 mg Untersuchungssubstanz
(schwefelhaltig)
(4) Kupfer(II)-oxid (in Drahtform)
(5) 3 ml Wasserstoffperoxid (c=10%)
(5a) 3 ml dest. Wasser
(6) 4 ml Wasserstoffperoxid (c=3%)
(6a) 4 ml dest. Wasser
Bariumchlorid-Lösung (gesättigt)
Natriumhydrogencarbonat
Silbernitrat-Lösung (C=0,1 mol/L)
Kaliumchromat-Lösung (c=10%)
Sonstiges: Analysenwaage, Hamilton-Spritze (nur bei Analyse
von Flüssigen Proben nötig), Natriumsulfat, Kaliumpermanganat, Quarzwolle,
Pipette mit Siphonsauger, kleine 1 ml Spritze mit Kanüle (Tuberkulin-Spritze),
Blauband-Filter, kleiner Trichter
|
Ergänzung: |
[ Didaktik
| Hilfe | Abbildung der Schwefel/Chlor-Apparatur (300dpi) | Realbild der Schwefel/Chlor-Apparatur (300dpi)
| Realbild
des Reaktionsrohres | automatisches Messprotokoll in Excel | |
Durchführung |
Aufbau: |
Die Verbrennungs-Analytische Analyse besteht als erstes aus der Gasreinigung wo Spuren der Gase
Schwefeldioxid, Schwefeltrioxid und
Schwefelwasserstoff aus der Syn.-Luft, Luft oder gar einer
Membranpumpe entfernt werden. Im Reaktionsrohr wird die Substanz unter
hoher Temperatur verbrannt, die Verbrennungsgase werden stufenweise in den
drei Gaswäschern in Wasserstoffperoxid-Lösung absorbiert.
Die Apparatur wird von hinten her mit Federklammern (weiße Kunststoffseite) versehen und an die beiden Alu-Vierkantrohre angeklipst.
Die Alu-Vierkantrohre werden an einem Stativ mit einer Muffe befestigt.
Alle Verbindungen werden noch einmal nachgezogen. Die Dichtheitsprobe
wird durch Zuhalten des
Gasausganges am letzten Gaswäscher mit dem Finger ,bei Durchströmung der Apparatur mit
Luft durchgeführt. Große Undichtigkeiten machen sich durch Zischen
bemerkbar.
|
Reaktion: |
Als erstes wird das Reaktionsrohr mit Kupfer(II)-oxid-Spänen gefüllt
wobei man am linken Ende 2,5 cm Platz bis zum Rohrende lässt. Am rechten
Ende wird 1,5 cm Platz gelassen zum Schutz der Verschraubungen. Danach wird Eisen(III)-chlorid-Lösung in den Vorwäscher
gefüllt und die Luft-Quelle angeschlossen. Zum Schluss füllt man die
drei Absorptions-Gaswäscher mit der betreffenden
Wasserstoffperoxid-Lösung (bzw. Wasser).
Man beginnt indem man das Reaktionsrohr heraus nimmt und mit der
Analysenwaage genau wiegt. Dann wird die Substanz (etwa 2-3 mg bzw. 5 µl)
auf die Quarzwolle gegeben und Nocheinmahl gewogen. Daraus berechnet man wie viel
Substanz im Reaktionsrohr vorhanden ist. Nun wird das Reaktionsrohr in die
Apparatur eingesetzt und ein Luftstrom erzeugt (etwa
2-3 Blasen/Sek.). Als nächstes erhitzt man das Reaktionsrohr in der Mitte bis
zum Glühen und verschiebt den Brenner nach links zur Substanz. Man
erhitzt den Reaktionsrohr-Teil mit der Substanz nun 5 min. bis zur hellen
Rotglut. Nach den 5 min. lässt man das Rohr in der Apparatur im Luftstrom
abkühlen.
Nun füllt man mit einer Pipette etwa 1 ml Bariumchlorid-Lösung in alle drei geöffneten Gaswaschflaschen. Die
Lösungen werden nun möglichst schnell durch das Blauband-Filter
gegossen. Der Filter wird vorher auf der Heizung für 5 min. getrocknet
und genau gewogen. Nach durchlaufen der kompletten Absorptionslösung wird
das Filter wieder für 5 min. auf der Heizung getrocknet und wieder
gewogen. Aus der Differenz der Gewichts-Messungen kann man die Masse des
ausgefallenen Bariumchlorides ermitteln.
Zur Bestimmung des Chlor (auch andere Halogene) wird wie bei der
Schwefelbestimmung verfahren nur das man zur Absorption Wasser verwendet.
Es wird wie oben beschrieben eine geringe Substanz-Menge eingewogen und verbrannt, wobei man die Temperatur der Flamme, mit hilfe der Luftzufuhr
nicht so hoch einregeln darf weil sonst die Verbrennung zu
Chlorwasserstoff nicht vollständig ist. Nach der Verbrennung wird die
Absorptions-Lösung mit etwas Natriumhydrogencarbonat neutralisiert und
nach Zugabe von 1 Tropfen Kaliumchromatlösung mit Silbernitrat-Lösung
aus einer Tuberkulin-Spritze (kleine fein graduierte Spritze mit Kanüle)
titriert. Es erfolgt ein Farbumschlag von gelb nach orange. Anschließend
wird das Volumen der verbrauchten Silbernitrat-Lösung notiert.
|
Entsorgung: |
Die Eisen(III)-chlorid-Lösung wird mit Natriumsulfat in
Eisen(III)-sulfat-Lösung umgewandelt. Diese Lösung kann in kleiner
Menge ins Abwasser gegeben werden. Das Filter mit dem Bariumsulfat
wird in den Hausmüll gegeben. Die Wasserstoffperoxidlösung die durch
den Filter gelaufen ist wird in der Filtrier-Vorlage (Reaktionsgefäß)
mit Natriumsulfat versetzt, sodass Bariumsulfat ausfällt. Ist die
Fällung beendet wird eine Spatelspitze Kaliumpermanganat hinzugegeben
um Wasserstoffperoxid in Sauerstoff und Wasser zu zerlegen. Die so
aufgearbeitete Lösung kann in den Ausguss gegeben werden. Das
Kupfer(II)-oxid wird gesammelt oder im Reaktionsrohr belassen für
weitere Elementaranalyse. Die titrierte Salzsäure-Lösung wird in das
Sammelgefäß für "Chromate" gegeben, da eine weitere
Entsorgung erst bei einer größeren Gesammelten Menge Sinn macht.
|
Beobachtung: |
Messergebnisse der Schwefelbestimmung (Diphenylthiocarbazon-Analyse) :
Filterpapier (vorher) : 321,4 mg
Filterpapier (nachher) : 329,23 mg
M(BaSO4): 7,83 mg
Reaktionsrohr vor der Einwaage: 84,56252 g
Reaktionsrohr nach der Einwaage: 86,0925 g
mAnalysensubstanz:
1,53 mg
Messergebnisse der
Chlorbestimmung (1,2-Dichlor-ethan -Analyse):
Reaktionsrohr vor Einwaage:
84,56252 g
Reaktionsrohr nach
Einwaage: 84,58352 g
MAnalysensubstanz:
11,00 mg
VSilbernitratlösung:
0,011 ml
zum Messprotokoll (zur
Auswertung von Chlor und Schwefel)
|
|
Folgerung
|
Deutung: |
Organische Verbindungen die Schwefel oder Chlor enthalten verbrennen
quantitativ zu Schwefeldioxid bzw. Chlorwasserstoff. Das Schwefeldioxid
wird bei der Schwefelbestimmung in Wasserstoffperoxid absorbiert und
anschließend die Sulfate mit Bariumchlorid-Lösung gefällt. Anschließnd
kann daraus der Schwefelgehalt der Verbindung ermittelt werden.
Der Chlorwasserstoff wird in Wasser absorbiert und nach Bestimmung der
Chlor-Ionen mit der Mohr-Titration lässt sich ebenfalls der Gehalt an
Chlor ermitteln.
|
Fakten: |
Eine organische Schwefelverbindung verbrennt quantitativ
zu Kohlendioxid, Wasser und Schwefeldioxid. Der Sauerstoff kommt aus dem
Kupfer(II)-oxid und der zugeführten Luft. Das Schwefeldioxid wird durch
den Sauerstoff des Wasserstoffperoxid zu Schwefeltrioxid oxidiert,
welches sich in dem Wasser löst. Die so entstandene Schwefelsäure
enthält Sulfat-Ionen, diese werden mit Bariumchlorid als unlösliches
Bariumsulfat ausgefällt und gravimetrisch bestimmt.
Die organischen Chlorverbindungen müssen Wasserstoff
enthalten, weil sich sonst kein Chlorwasserstoff sondern nur Chlor bildet, welches aber auch wegen seiner geringen Konzentration in Wasser löslich ist. Die mit Wasser gebildete Salzsäure oder das Chlorwasser werden bei der Neutralisation mit Natriumhydrogencarbonat in Natriumchlorid umgewandelt. Die Chlorid-Anionen bilden mit der genormten Silbernitratlösung Silberchlorid. Wenn alle Chlorid-Ionen in Form von
Silberchlorid gebunden sind, bildet sich ein Überschuss an Silber-Kationen welcher sich durch
Bildung der roten-orangen
Silberchromates mit Kaliumchromat-Lösung bemerkbar machen.
Mit dieser Methode lassen sich außer Chlor noch Brom, Iod und je nach Verbindung auch Fluor-Gehalt einer organische Substanz
bestimmen.
|
Fragen: |
Wie lässt sich Phosphor in organischen Phosphor-Verbindungen bestimmen?
|
|
Literatur und Bearbeitung |
Autor (Text): |
 Stephen Schulz
Stephen Schulz |
| Bearbeitung (www): |
Klaus-G. Häusler  haeusler[at]muenster[dot]de;
haeusler[at]muenster[dot]de;
|
| Quelle: |
 Anregung
durch:
http://www-uni-bayreuth.de/departments/didaktikchemie/umat/aufschluss/aufschluss.htm Anregung
durch:
http://www-uni-bayreuth.de/departments/didaktikchemie/umat/aufschluss/aufschluss.htm
|
Literatur: |
Allgemeine Elementaranalyse (auch
Schwefel) der Uni-Würzburg :
http://www.univie.ac.at/Mikrolabor/chns.htm
Bestimmung des PVC-Gehaltes über den Chlorgehalt der Uni-Bielefeld:
http://www.dc2.uni-bielefeld.de/dc2/pvc/pvc_v01.htm |

![]() haeusler[at]muenster[dot]de;
uiw/chemie/elementaranalyse_cl_s_org.htm_28.06.04
haeusler[at]muenster[dot]de;
uiw/chemie/elementaranalyse_cl_s_org.htm_28.06.04