| Der Redox-Begriff am Beispiel der Redoxpaare Kupfer/Kupferoxid, |
|
Übersicht
|
||||||||||||||||||||||||
0. Didaktische Anmerkungen zur Unterrichtsthematik "Redox-Reaktion"
Der Typ der Redox-Reaktion ist eine der drei wesentlichen Stoffumsetzungen, die es im Anfangsunterricht der Chemie kennenzulernen gibt. Die optisch gut zu verfolgende Reaktion von Kupfer mit Sauerstoff ist dabei häufig ein Einstiegsexperiment. Im Kupferbriefchen-Experiment dient die Reaktion einmal zur Entdeckung des Sauerstoff in der Luft, zum anderen der Bildung von Kupferoxid und Unterscheidung von Ruß. Hieran wird auch die erste (vorläufige) Definition von Oxidation als Verbindungsbildung mit Sauerstoff definiert. Der Versuch, aus Kupferoxid wieder Kupfer zurückzugewinnen, kann mit Erdgas, Kohlenstoff (Holzkohle) oder Wasserstoff erfolgen. Die Rückführung wird Reduktion genannt. Dabei ist aber zu erkennen, dass die Reduktion des Kupferoxids mit einer Oxidation eines anderen Stoffes verbunden ist. Diese Erkenntnis führt zur Begriffsbildung des "Redox-Begriffes". Ein anderer Einstieg, sich dem Redox-Begriff zu nähern, ist die Reduktion von Wasserdampf mit Magnesium und die Knallgasreaktion als Oxidation des Wasserstoffs mit Sauerstoff. Eine dritte und didaktisch bedeutende ist Nutzung der Elektrochemie (Hofmann-Elektrolyse mit wässrigem Kaliumsulfat Im Folgenden werden nun einige wesentlichen Experimente aus dem Bereich der Redox-Reaktionen mit Kupfer, Sauerstoff und Wasserstoff aufgeführt, wie sie in Mit halbmikrotechnischen Methoden in Schülerübungen durchgeführt werden können.
|
||||||||||||||||||||||||
1. Magnesium reagiert mit verdünnter Essigsäure zu Wasserstoff und Magnesiumacetat. Mit dem gebildeten Wasserstoff kann man die Knallgasprobe einüben. |
Bild: Einfache Apparatur zur Gasentwicklung aus einem Feststoff und einer Flüssigkeit
|
|||||||||||||||||||||||
Knallgasprobe mit Filmdöschen Kopfloch bohren Wasserstoff einfüllen (mit dem Kopfloch nach unten) Wasserstoff zünden (mit dem Kopfloch nach oben)
|
Bild: Zünden von Wasserstoff in Filmdöschen als Versuch zur Demonstration der Explosionsgrenze
|
|||||||||||||||||||||||
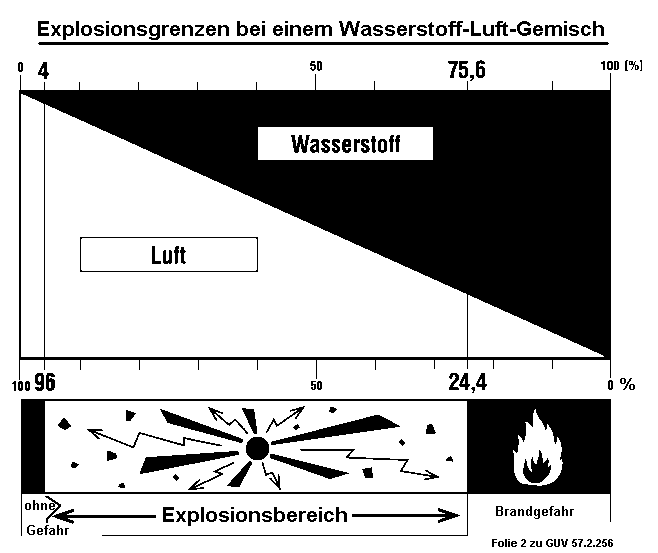
Beim Zünden hört man nur ein sehr leises ploppendes Geräusch, die Flamme sieht man zunächst nicht. Wasserstoff brennt mit einer unsichtbaren Flamme. Erst wenn der Kunststoff mit verbrennt, kann die Flamme aufleuchten. Wenn man langsam mit viel Wasserstoff gefüllt hat, so dass der Inhalt weitgehend aus reinem Wasserstoff besteht, kann es bis zu 15 Sekunden dauern, bis es zu einer Verpuffung bzw. Explosion kommt. - Es muss erst der Wasserstoff, wegen seiner geringeren Dichte noch oben, brennend entweichen. Dadurch dringt durch das Seitenloch Luft von unten ein und bildet eine Luft/Wasserstoff-Grenzschicht. Wenn dieses Gemisch bis in die Nähe der oben brennenden Flamme steigt, kommt es zur Explosion. |
Bild: Explosionsgrenzen von Wasserstoff/Luft-Gemischen |
|||||||||||||||||||||||
|
Die gezeigte Apparatur dient dazu, luftfrei Wasserstoff aus Magnesium und verdünnter Essigsäure zu gewinnen. Über ein Kunststoff-Kupplungsstück (E), ein Luer-Lock-Kupplungsstück (F) ist ein GL18-Glasrohr angeschlossen. Dieser Teil der Apparatur ist für alle Gasentwicklungen aus einer Flüssigkeit und einem Feststoff geeignet. (Allgemeine Beschreibung: Methode) |
Bild: Apparatur zur Entwicklung von Wasserstoff mit verd. Essigsäure
|
|||||||||||||||||||||||
| 2. Das gebildete Wasserstoffvolumen ist proportional der eingesetzten Magnesiumportion.
|
Durch die Umsetzung von Magnesiumband mit verdünnter Essigsäure wird Wasserstoff gebildet. Die Bestimmung des gebildeten Wasserstoffvolumens kann auf einfache Weise zur Bestimmung der molaren Masse von Metallen genutzt werden.
|
|||||||||||||||||||||||
Die Beziehung kann genutzt werden um
|
Tabelle: Volumen von Wasserstoff nach der Umsetzung von Magnesiumband mit verd. Essigsäure
|
|||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
||||||||||||||||||||||||
| |
3. Kupfer wird mit Luftsauerstoff zu schwarzem Kupfer(II)-oxid oxidiert. Diese Reaktion wird Oxidation genannt (Methode in Vorbereitung: Oxidation von Feststoffen mit Gasen).
|
|||||||||||||||||||||||
| |
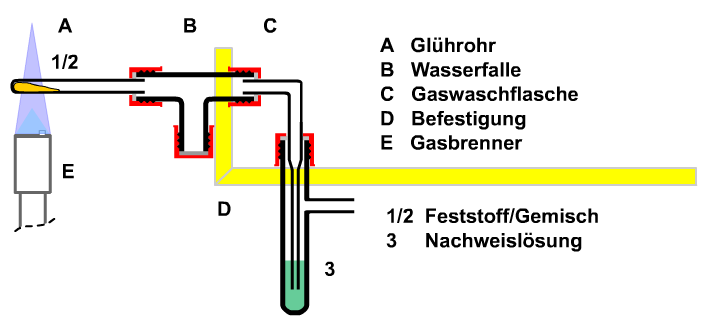
4. Reduktion von Kupferoxid mit Kohlenstoff zu Kupfer und Kohlenstoffdioxid Die Rückführung des Kupfers kann mit Kohlenstoff (Holzkohle, Methode in Vorbereitung: Lötrohrpraxis) mit dem Lötrohr oder im Reagenzglas durchgeführt werden. Hierbei entsteht neben dem Kupfer auch Kohlenstoffdioxid. Versuche hierzu auch beim Thema "Metalle". Soll das gebildete Kohlenstoffdioxid nachgewiesen werden, ist die nebenstehende Apparatur zu verwenden.
|
Bild: Apparatur zur Umsetzung von schwarzem Kupferoxid mit Kohlenstoff |
||||||||||||||||||||||
Bei der Reaktion von Kupferoxid mit Kohlenstoff werden hohe Temperaturen zur Aktivierung benötigt . Anschließend entsteht eine exotherme Reaktion. Die starkwandigen Gewinde-Gläser können dabei Schaden nehmen. Daher wird das Reaktionsgemisch aus Kupfer und Kohlenstoff in einem Quarzrohr zur Reaktion gebracht. Mit entsprechender Vorsicht (Unterstellen einer feuerfesten Unterlage) kann auch ein Borosilikatglas mit etwa 1,5 mm Wandstärke verwendet werden. Steht ein Gebläsebrenner zur Verfügung, kann das Rohr auch zu einer Kugel ausgeblasen werden. Da keine giftigen Stoffe bei der Reaktion verwendet oder freigesetzt werden, kann auch AR-Glas als Reaktionsröhrchen benutzt werden, wobei allerdings mit dem Erweichen des Röhrchens während zu rechnen ist. AR-Glas hat den Vorteil, bei Schülerübungen im Glasblasen eingesetzt werden zu können, da es bereits in der rauschenden Gasbrennerflamme eines gut ziehenden Brenners erweicht.
|
Bilder: Zwischenstufen beim Anfertigen von Glühkugeln |
|||||||||||||||||||||||
5. Die Reduktion kann auch mit Erdgas oder Propan durchgeführt werden. [ Methode in Vorbereitung: Oxidation von Feststoffen mit Gasen (g + f --> x + g) ]
|
Bild: Apparatur zur Umsetzung von schwarzem Kupferoxid mit Erdgas |
|||||||||||||||||||||||
6. Wasserstoff als Reduktionsmittel für Kupferoxid Experiment: Wasserstoff als Reduktionsmittel für Kupferoxid Dabei entsteht neben dem Kupfer auch Wasser.
|
Bild: Apparatur zur Oxidation von Kupfer mit Luftsauerstoff zu Kupferoxid; |
|||||||||||||||||||||||
Lernkarteiblatt zum Schülerexperiment: Metalle, Reduktion und Oxidation Lernkartei Metall, Reduktion und Oxidation als .pdf
|
Lernkarteiblatt zum Schülerexperiment: Redox-Prozess und Redoxbegriffe Lernkartei Redox-Begriffe als .pdf
|
|||||||||||||||||||||||
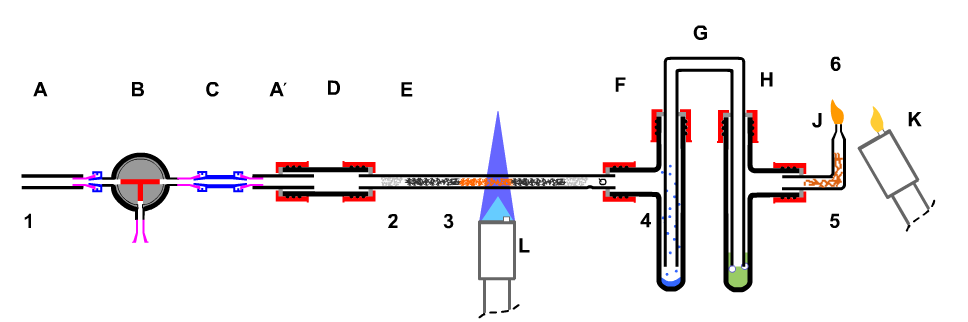
| 7. Halbquantitative Bestimmung des Sauerstoffgehaltes von Luft durch Oxidation mit einer abgemessenen Luftportion und anschließender Reduktion mit Wasserstoff. Schülerexperiment (ohne Beobachtungen und Auswertung):
|
||||||||||||||||||||||||