|
Leitseite zum Thema: Kalkkreisläufe - eine Einführung in die Behandlung von chemischen Gleichgewichten |
07.11.16; fortzusetzen |
|
Übersicht
|
|||
0. Didaktische Anmerkungen Denken in Gleichgewichten Schülerinnen und Schüler sollen am Beispiel der verschiedenen "Kalkkreisläufe" die Existenz von Gleichgewichten in der Natur entdecken. Zu den chemischen Gleichgewichten kommt man, wenn man den Einfluss von Energie auf Stoffe untersucht. Für diese Experimente eignet sich gut das Brennen von Kalk, weil die zu behandelnden Stoff nur in geringem Maße gefährlich sind und die Experimente mit geeigneten Apparaturen in Schülerübungen möglich sind. Der Nachweis und die Rückführung (Recycling) der beim Kalkbrennen entstehenden angeregten Stoffe bieten den Einstieg zur Diskussion von
Naturwissenschaftliches Denken: Induktion, Deduktion und Abduktion Zur Entdeckung der chemischen Gleichgewichte werden chemische Experimente unter Benutzung einfacher Naturgesetze geplant, durchgeführt und die Beobachtungen gedeutet. Die entstehenden Stoffe werden entsorgt, bis sich wieder alles im natürlichen Gleichgewicht befindet.
Im Folgenden soll am Beispiel des "Glühens von Marmor" aufgezeigt werden, wie man Schülerinnen und Schüler an die Existenz von chemischen Gleichgewichten heranführen kann. Außerdem sollen Schülerinnen und Schüler erkennen, wie durch technische Prozesse die natürlichen chemischen Gleichgewichte verändert werden, warum das in der Technik sinnvoll angewendet werden kann und was dabei beachtet werden muss, damit keine Gefährdung durch Chemikalien entstehen. Arbeitshypothese: Die uns umgebenden Stoffe, die nicht zu Lebewesen gehören, befinden sich alle in einem natürlichen Gleichgewicht. Sie bleiben in der Form erhalten, obwohl sie sich berühren. Man sagt, sie reagieren nicht miteinander. - Will man dieses Gleichgewicht stören und neue Stoffe entstehen lassen, die so nicht in der Natur vorkommen, so muss man mit Energie auf das bestehende Gleichgewicht einwirken. Um die Veränderungen des Anfangsgleichgewichts zeigen zu können, benötigt man in der Chemie Indikatoren
|
|||
1. Vorkommen von "Marmor" das Mineral Calcit Marmor Tropfstein und Tropfsteinhöhlen Eierschalen, Schneckengehäuse, Muscheln und Muschelkalk Mörtel
|
2. (Mechanisches) Stören eines natürlichen Gleichgewichts im Labor Die Verwendung vom Marmor in der Kunst Zunächst wird ein Stückchen "Marmor-Fensterbank" mit dem Hammer zerkleinert. Der Ausgangsstoff Marmor und alle noch so klein gehämmerten oder zerriebenen Bruchstücke reagieren mit wässriger Bromthymolblau- Lösung (BTB) mit grüner Farbe (neutral). Offenbar benötigt man noch größere Mengen Energie, um Marmor chemisch zu verändern, so dass neue Stoffe mit anderen Eigenschaften entstehen.
|
Bild: Abspalten und Pulverisieren von Marmor mit dem Hammer
|
| |
3. "Zerkleinern" durch Erhitzen Aus der Erfahrung mit Lebensmittel weiß man, wie man diese erhalten oder verändern kann. Durch Einfrieren, Entzug von (Wärme-)Energie, bleiben sie unzersetzt erhalten. Will man sie jedoch verändern, so muss man (Wärme-)Energie durch Kochen, Braten oder Backen zuführen. Diese Idee wird auch auf Marmorpulver angewendet.
Zunächst wird in einem Porzellantiegel das Marmorpulver einschließlich kleinerer Kristalle in eine Eisentiegel mit der rauschenden Flamme eines Teclu-Brenners oder Gebläsebrenner geglüht. Dabei zerfallen die weißen, glänzenden Kristalle. Es bildet sich ein weißes Pulver. Mehr kann man bei dieser Experimentierausführung nicht erkennen. Um die Natur genauer zu erkennen, muss man einen Teil aus der Natur entnehmen und vollständig abtrennen. Man nennt das im Anfangsunterricht eine "abgeschlossene Apparatur", später wie in allen anderen Naturwissenschaften, ein "System". Auf dieses System wirkt man nun mit hoher Wärmeenergie ein.
|
5.Thermolyse von Marmorpulver in einer halbgeschlossenen Apparatur Aus dem Experiment vom "Luft erhitzen" weiß man wie stark sich die Luft ausdehnen kann. Nun wird der gleiche Versuch mit eingefülltem Marmorpulver durchgeführt. (Bild 2)
|
Bild: Verhalten von Marmor beim Erhitzen
|
||
Es entweicht deutlich mehr Gas als beim Erhitzen von Luft. Das frei werdende Gas bildet mit Wasser eine Säure. Das Gas kann nur durch Zersetzung von Marmorpulver entstanden sein. Der weiße Rückstand des Marmorpulvers kann nicht mehr die alle Eigenschaften von Marmor besitzen. Wenn die Idee vom Gleichgewicht richtig ist, muss der Rückstand mit Wasser eine Lauge bilden. Weiter muss sich beim stufenweisen Zugabe der blau gefärbten Lösung des "gebrannten Marmors" zu der gelb gefärbten wässrigen Lösung des Gases die Ausgangsfarbe grün ergeben und so die Rückbildung des Marmors anzeigen. Das jedoch gelingt nur unvollständig. Zwar kann man nach jeder Zugabe den Farbwechsel blau und zurück zu gelb beobachten und auch dass die Lösung kurz vor der Gesamtvereinigung nahezu grün ist. Wenn man allerdings die vereinigten Lösung zu dem Rest der Lösung des gebrannten Kalks gibt, bleibt die Lösung blau. Zum ausführlichen Schülerexperiment Für den weiteren Verlauf kann es didaktisch nützlich sein, den selbstgebrannten Kalk in größerer Menge herzustellen und zu zeigen, das der "gebrannte Kalk" Energie als chemische Energie gespeichert hat und diese beim "Löschen" mit Wasser wieder abgibt. Außerdem kann man den gebrannten Kalk zur Herstellung von frischem Kalkwasser verwenden und so die Unterrichtseinheit "Stofftrennung durch Filtrieren" in Schülerübungen umsetzen. |
|||
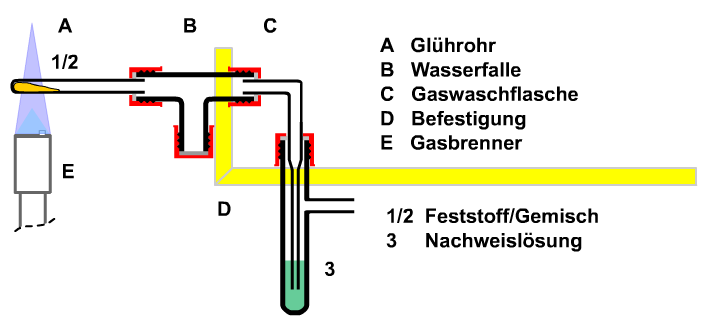
6. Untersuchung von Raumluft und Atemluft Die Hyphothese, dass gasförmiges Kohlenstoffdioxid in der Atemluft enthalten ist, muss bewiesen werden. Dazu muss ein und derselbe Atemzug durch Reaktion mit Kalkwasser und mit Bromthymolblau-Lösung (ph=7) geprüft werden. Das kann mit der nebenstehenden Apparatur geschehen. Beim Einatmen steigt die Indikatorlösung aus der Gaswaschflasche (D) zurück in die Sicherheitswaschflasche (C). Die Wasserfalle (B) verhindert zuverlässig, Indikatorlösung durch zu kräftiges Einatmen in den Mund gelangt. Beim Ausatmen wird die Lösung aus der Sicherheitsflasche (C) bis auf einen Rest wieder zurück in die Gaswaschflasche (D) befördert. Dabei trübt sich die Kalkwasserlösung, die BTB-Lösung ändert ihre Farbe von blaugrün nach gelb. Zu kräftiges Ausatmen lässt die Indikatorlösung aus der Apparatur schwappen.
|
Bild: Untersuchung von einem Atemzug auf Kohlenstoffdioxid beim Einatmen und Ausatmen |
||
Bei dieser Apparatur lässt sich mehreres erfahren. Die Bennung der verschiedenen ähnlich aussehender Glasrohre ist zu umständlich. Besser ist die Bennenung der Apparaturteile nach der Funktion (siehe Abschnitt 7). Das Kalkwasser trübt sich nicht beim Einatmen, jedoch beim Ausatmen. Die Trübung setzt sich am Boden ab (Fachausdruck Niederschlag). Der Niederschlag löst sich mit verdünnter Essigsäure (Nachweis für Carbonate). -> Nachweisgrenze, Grenzkonzentration Anmerkung: Das Kalkwasser trübt sich nicht beim Einatmen von Raumluft, obwohl doch während des Unterrichts längere Zeit Menschen in dem Raum ausgeatmet haben. Offensichtlich ist der chemische Nachweis nicht empfindlich genung, um geringe Spuren von Kohlenstoffdioxid in der Luft nachzuweisen. Mit Barytwasser, Ba(OH)2-Lösung geleingt der Nachweis. Da Barium-Ionen Schwermetallionen sind, ist der Versuch als Schülerexperiment nicht zulässig. -> Grenzkonzentration
|
|||
7. Art der technischen Namensgebung Der Mensch benutzt die Sprache, um sich miteinander verständigen zu können. Menschen müssen unter einem Wort auch das Gleiche verstehen. Das Wortverständnis wird vom Kind durch Imitation und Verstärkung durch Lob oder Verständigungserfolg erlernt. Das geschieht durch Nachsprechen ohne Nachzudenken, zum Beispiel Vater, Mutter, Opa, Oma ... (siehe auch Fachsprache Werden die Sachverhalte der Unterscheidung komplizierter, so werden die Wörter erweitert. Das geschieht in der deutschen Sprache durch vorangestellte Wörter: Name wird zu Vorname, Rufname, Spitzname, Nachname ... Der allgemeine Wortschatz wird in den verschiedenen Fachbereichen durch Fachausdrücke ergäntzt. Diese Ergänzung nennt man Fachsprache oder ach Fachterminologie. In den Wissenschaften müssen die Fachbegriffe noch genauer abgegrenzt und festgelegt werden. Hier werden die Wörter definiert. (definitio lat. Abgrenzung
|
|||
Wichtig ist, dass man die Fachsprache in die allgemein verständliche Sprache "übersetzen" kann. Daher gibt es zum Beispiel bei der Benennung von Geräten in der Technik Regeln, nach denen man die Geräte beschreibt. 1. Bennennung nach Form, Farbe, Material und Aussehen. Es ist keine große Fachkenntnis erforderlich. Diese Beschreibung dient nur der groben Unterscheidung und kann sehr schnell umständlich werden. So ist eine "blaue Glaskugel" leicht von einem "roten Gummiball" zu unterscheiden. Bei vielen ähnlichen Gegenständen wie den in der Chemie gebräuchlichen verschiedenen Glasrohren ist das zu umständlich.
|
|||
2. Bennenung nach der Funktion. Hierzu ist mehr Fachkenntnis nötig. Wollte man allein die verschiedenen rechtwinkligen Glasrohre in den beiden Bildern nach der Form unterscheiden, würde das zu untauglich langatmigen Ausführungen kommen. Zu dem würde bei dieser Art der Beschreibung viel Aufmerksamkeit auf die Unterschiede der Bauteile B in den beiden Apparaturen gebunden, was eigentlich nicht nötig ist. Die Bauteile B haben in beiden Apparaturen die gleiche Funktion, es sind "Wasserfallen".
|
|||
|
|
||
Bilder alternative Wasserfallen; Benennung nach Funktion A Lufteinlass/-auslass; B Wasserfalle; C Sicherheitswaschflasche; D Gaswaschflasche; E Stativbefestigung
|
|||
3. Die Beschreibung nach dem Hersteller oder Erfinder. Hierfür sind die umfangreichsten FAchkentnisse erforderlich. Diese Beschreibung benutzt man, wenn es zum Beispiel viele ähnliche Geräte mit gleicher Funktion gibt. Das ist der Fall die den vielfältigen Laborkühlern, die in der chemischen Apparatetechnik eingesetzt werden (Laborkühler
|
|||
|
|
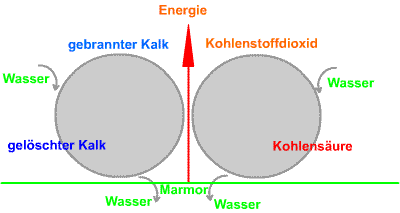
Bild: der technische Kalkkreislauf |
||