|
|
|
|
Ziel und Zweck:
Experiment zur Entfernung eines metallischen Überzuges von einer Platin-Elektrode + Pt/Cu//CuSO4,aq//Cu -, um die Platin-Elektrode wieder verwenden zu können.
|
|
|
Vorwissen: |
elektrischer Stromkreis
Leiterarten |
| |
Bei der Elektrolyse werden Stoffe, die aus Ionen aufgebaut sind, zersetzt. Diese Stoffe bestehen aus Kationen (positiv geladene Ionen) und Anionen (negativ geladene Ionen). |
|
|
Experiment: |
|
| |

Bild 2: Gleichstrom-Elektrolyse eine Kupfersulfat-Wasser-Lösung mit einer Kupfer-Katode und einer mit Kupfer überzugenen Platin-Anode
Geräte:
U-Rohr, 4 Schraubkappen mit Dichtung,
Regelbare Gleichspannungsquelle mit Ein/Ausschalter, Amperemeter, Voltmeter, Kabel; Halter für Elektroden (gegebenenfalls 2 Krokodilklemmen)
Sonstiges:
Stativ; Muffe; Klammer;
feines Schmirgelpapier
Chemikalien
gesättigte Kaliumsulfat-Lösung in Wasser; Bromthymolblau (BTB) Säure-Basen-Indikator;
Platin-Elektroden,
|
|
|
|
|
Aufbau, Sicherheitsmaßnahmen und Entsorgung:
Persönliche Schutzmaßnahmen: Beim Umgang mit Gefahrstoffen ist immer eine Schutzbrille zu tragen. Es ist vorteilhaft, einen Schutzkittel zu tragen.
WäHrend des chemischen Experimentes läuft ein dünner Wasserstrahl, damit man sich nach einem versentlichen Kotakt mit Chemikalien sofort die Hände waschen kann.
Der Aufbau und die Schaltung geschieht nach Skizze. Anschließend gibt man eine kalt gesättigte Lösung von blauem Kupfersulfat (CuSO4*5 H2O) in Wasser dazu, bis die Elektroden bedeckt sind.
Entsorgung:
Die Kupfersulfatlösung wird in das Vorratsgefäß zurückgegeben. Die Kupfer-Elektrode und Platin-Elektrode werden abgespült, getrocknet und sind wieder zu verwenden.
|
|
|
Durchführung und Beobachtung: |
|
|
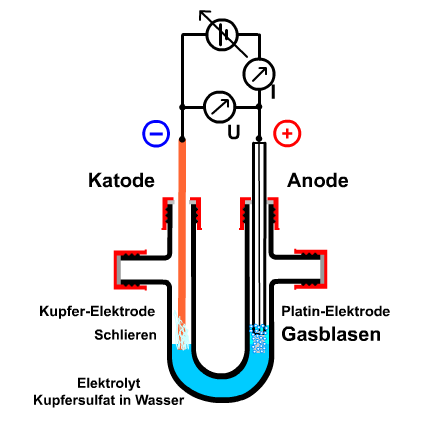
- Die Vorgänge an der Kupfer-Katode bleiben gleich, braun-scharzes, flockiges Kupfer scheidet sich ab.
- Das Kupfer an der verkupferten Platin-Elektrode löst sich auf und das silbrig glänzende platin wird wieder sichtbar.
- Bevor man die elektrische Schaltung abschalten kann, bilden sich an der Platin-Anode feine Bläschen.
- Auch bei längerem Stromdurchgang löst sich die Platin-Anode nicht auf, stattdessen bildet sich fortwährend ein farbloses Gas.
- Sobald man die Spannung abschaltet, hört der Stromfluss und die Entwicklung der Schlieren und Blasbenbildung auf.
|
|
|
Auswertung:
- Die Vorgänge an der Anode bleiben unverändert: Das Kupfer-Anodenblech löst sich unter Bildung von blauen Kupfer-Kationen auf.
- Die Kupfer-Kationen gehen an der Platin-Anode in Lösung.
- Der Stromdurchgang wird auch nach der Auflösung des Kupfer-Überzuges an der Platin-Elektrode abbrochen. Es geht aber auch kein Platin in Lösung.
- An der Anode entwickelt sich ein farblose Gas, das offenbar seinerseits in Lösung als Anion vorhanden gewesen ist. Die Möglichkeit, dass sich aus dem Platin ein Gas entwickelt hat
|
|
|
Ergebnis:
Bei der Elektrolyse von Kupfersulfat-Lösung geht an der Anode elementares Kupfer unter Bildung von Kupfer-Kationen (positiv geladenen Ionen) in Lösung. Die Ionen wandern zur Katode und werden dort wieder neutralisiert und als elementares Kupfer abgeschieden.
|
|
| |
|
|
|
Folgerung:
Die wertvolle Platin-Elektrode muss wieder vom Kupfer befreit werden. Dazu kann man das gewonnenen Wissen anwenden.
Da sich Kupfer an der Anode auflöst und in Lösung geht, braucht man nur umzupolen, dann müsste das Kupfer wieder in Lösung gehen.
Vermutung: Man sollte nur solange Strom durch die Lösung schicken, bis alles Kupfer aufgelöst ist. Dann sollte man sofort abschalten, damit nicht anschließend auch das wertvollere Platin aufgelöst. 
Ausblick:
nächster Versuch  |
|
|
|
|
|
|
Literatur:
Quellenangabe (bei Übernahme von Inhalten)
weiterführende Literatur
|
|
|
|
|
|
Copyright 2005-2015 HMTC Halbmikrotechnik Chemie GmbH; www.halbmikrotechnik.de
|
15.08.10 |
![]() zu
den didaktischen Anmerkungen
zu
den didaktischen Anmerkungen![]() zur Lernkartei
zur Lernkartei