Der Energie-Erhaltungssatz
und
seine Bedeutung für Chemie und Unterricht

12.05.2016
Gliederung:
1. Der Energie-Erhaltungssatz und seine Bedeutung für Chemie und Unterricht
1.1.1 Die Probleme der technischen Chemie
1.1.2 Die Aufgaben der wissenschaftlichen Chemie
1.2 Die Situation der Chemiedidaktik
2 Der Energie-Erhaltungssatz und seine Bedeutung für den Umgang mit Chemie
2.1 Der Energie-Erhaltungssatz als Grundlage des chemischen Gleichgewichtes
2.2 Der Stoffwechsel als Grundlage des Lebens
2.3 Chemische Reaktionen mit akademischer Fragestellung
2.4 Chemische Reaktionen mit technisch-industrieller Zielsetzung
3 Das Ziel von Chemieunterricht
Vorwort
Ziel des Chemieunterrichts an allgemeinbildenden Schulen ist es, ein Grundverständnis für die Reaktion von Stoffen zu erwerben. Damit das altersgemäß durch eigene Erfahrungen geschehen kann, war es notwendig chemische Laborgeräte so zu entwickeln, dass von sicher und sachgerecht durchgeführten Experimenten keine Gefährdungen ausgehen.
Begonnen wurde die Geräteentwicklung von mir 1978. Erste Prototypen kamen etwa 1981 zum Einsatz, damals allerdings noch ohne abgeschlossene Systeme zu realisieren. Die Abluft bei Experimenten wurde mit Aktivkohle gefiltert. Mit der Anwendung der Gefahrstoffverordnung Ende der 80iger Jahre rückte diese halbmikrotechnische Arbeitstechnik in den Blick zunächst nur weniger Fachkolleginnen und �kollegen. Seitdem wurde konsequent die Umsetzung das Arbeiten in geschlossenen Systemen [ §19.1 der Gefahrstoffverordnung (GefStoffV vor 2004; jetzt §9 GefStoffV 23.12.2004] verwirklicht. Seit 1994 ist das Experimentieren im halbmikrotechnischen Maßstab und in geschlossenen Apparaturen Gegenstand der landesweiten Lehrerfortbildung in Nordrhein-Westfalen und der Sicherheitsschulung der Gemeindeunfallversicherungsverbände (GUVV) Westfalen-Lippe und des Rheinlandes.
Diese Ausarbeitung hat zum Ziel,
• über die Bedeutung des Energie-Erhaltungssatzes zum Verständnis der Existenz chemischer Gleichgewichte zu gelangen ( statisches Naturgesetz ) ,
• aus der Erkenntnis der Existenz von Gleichgewichten auf die Notwendigkeit zu schließen, dass diese erhalten werden müssen ( dynamische Evolution) ,
• durch Verwendung geschlossener und teilgeschlossener Systeme Gefährdungen auf dem Wege zur Erkenntnis auszuschließen ( technische Nutzung ),
• nachzuweisen , dass durch Stoffminimierung nicht nur die Gefährdung, sondern auch die Versorgung und Entsorgung minimiert wird ( ökologische Optimierung ),
• darzustellen, wie durch den Einsatz der Halbmikrotechnik diese Zusammenhänge im Unterricht erarbeitet werden können ( methodisch-didaktische Umsetzung ),
• Schülerinnen und Schüler anzuleiten, durch eigenes Tun auch die Verantwortung für ihr Handeln übernehmen zu lernen ( Handlungsorientierte Schulung zur Übernahme von Verantwortung ).
Obwohl die Frage, wann ein Stoff ein Gefahrstoff ist, seit Paracelsus bekannt und beantwortet ist, wird von den Befürwortern und Gegnern der industriellen Chemie keine einheitliche Bewertung eines Stoffes erzielt. Grund ist, dass bislang ein Kriterium fehlt, unter welchen Bedingungen ein Stoff, ein Zustand oder ein Ablauf in der Natur als "gefährlich" angesehen werden muss. Ursache ist der Mangel an Verständnis, was �natürlich� ist. Hier kann sehr wahrscheinlich der für alle Naturwissenschaften gültige Satz herangezogen werden: �Alles in der Natur befindet sich im Gleichgewicht. � Dieser Satz bildet sozusagen der �Nullpunkt� der Bewertungsskala. Man kann dann den Grad der Abweichung von einem natürlichen Gleichgewicht als Störfaktor bewerten. Auf chemische Gleichgewichte bezogen ist dann eine weitere Differenzierung in Stoff-Systemen nach Vorkommen, Verteilung, Konzentration, Einwirkungszeit und Substrat nötig. In folgenden Ausarbeitungen werde ich auf die chemischen Aspekte und deren didaktische Vermittlung eingehen.
1. Der Energie-Erhaltungssatz und seine Bedeutung für Chemie und Unterricht
• Die Situation der Chemie
1.1 Die Situation der Chemie
1.1.1 Die Probleme der technischen Chemie
Ohne Zweifel hat die Ausweitung der Gültigkeit der Gefahrstoffverordnung für den Chemieunterricht an allgemeinbildenden Schulen Zeichen gesetzt. Sie spiegelt die Reaktion der Gesellschaft auf das steigende Unbehagen bei der Nutzung der Chemieprodukte wider. Große Teile gegenwärtiger Umweltprobleme werden der technischen Chemie angelastet. Die chemische Industrie ist sich des Imageverlustes bewusst, obgleich sie auf unbestrittene Erfolge bei der Bewältigung einer Vielzahl von Problemen der Massengesellschaft verweisen kann [1]. SIEFERLE [2] beschreibt die Ursachen der Technikkritik nach einer Analyse auf der Basis historischer Betrachtungen so:
�Es ist wenig wahrscheinlich, daß die vielfachen ökologisch relevanten Aktivitäten der Menschheit sich genau in der Weise neutralisieren, daß diejenigen umweltrelevanten Zustände erhalten bleiben, die vor diesen Eingriffen existierten und deren weitere Existenz für das menschliche Leben wünschenswert ist. Zugleich scheint heute der Versuch wenig erfolgträchtig, künstlich solche erwünschten (ökologischen, klimatischen, atmosphärischen und so weiter) Bedingungen wiederherzustellen, da die betroffenen Systeme zu komplex und zu groß sind, um wirklich verstanden, geschweige kontrolliert und gemanagt werden können. Zugleich zeichnet sich kein einfacher Weg ab, wie die Funktionslogik etwa der Industrie auf die Implementierung ökologischer Randbedingungen ausgerichtet werden könnte, ohne deren Funktionsweise, was ihre eigenen Zwecke betrifft, zu stören oder gar lahm zu legen. Das Problem liegt also in der mittleren Reichweite der heutigen industriellen Technik. Sie ist einerseits kompetent genug, um die natürliche Pufferungskapazität der Biosphäre zu überschreiten, gleichzeitig aber der Aufgabe nicht gewachsen, das Ganze der Naturzusammenhänge zu berücksichtigen.�
Damit wird die Situation der industriellen Nutzung von Chemie eingebettet in die Problematik der Technikanwendungen überhaupt, wie sie von Jonas [3] aufgezeigt wurde. Jonas stellt fest, dass Technik notwendig ist, weil durch sie erst die Lebensbedingungen für den Menschen insbesondere in unseren Breiten geschaffen werden. Der Einfluss der Technik erreicht durch die zunehmende Industrialisierung globale Dimension; dadurch gerät die Natur in den menschlichen Verantwortungsbereich. Größenordnung, Unumkehrbarkeit, Langzeitwirkung, kumulativer Charakter, positive Rückkopplung des technischen Handelns verlangen nach JONAS eine Ethik, die in ihrer Wirkung über den kategorischen Imperativ Kants hinaus auch die Verantwortung für künftige Generationen berücksichtigen muss. Offen bleibt bei ihm die Frage, ob überhaupt und wie die Chemie als Naturwissenschaft einen Beitrag zur Lösung dieser Aufgabe leisten kann.
Zu verschiedenen Zeiten empfand die Gesellschaft den technischen Fortschritt als Hoffnung oder Bedrohung. Das hängt davon ab, in welcher Weise Gesellschaft und Technik aufeinander einwirken. Sieferle [4] bemerkt dazu:
�Nun scheinen kulturelle Prozesse anderen Imperativen zu folgen als die technisch-industrielle Entwicklung. Aus der Perspektive der chemischen Industrie erscheint das, was im symbolischen Feld Kultur geschieht, als bloße Störung »von außen«, die nach den Regeln , die innerhalb des eigenen Systems gelten, verarbeitet werden müssen. Umgekehrt gilt für den kulturellen Bereich die Dynamik der Technik ebenfalls als Störung, auf die man in der eigenen Sprache reagieren muß, wobei ein Verständnis von keiner der beiden Seiten garantiert ist....
... Da die Welt jedoch eine Einheit bildet, kommt man nicht umhin, die Realität dessen zu akzeptieren, was in fremden sozialen Teilbereichen geschieht, und zu versuchen, in der jeweils angemessenen Sprache und Vorstellungsform seine Position zu vertreten, mit dem Ziel, Technik, Industrie und Kultur in einen Kommunikationsprozess einzubinden.�
Missverstehen und gegenseitige Schuldzuweisungen [5] lösen das Problem nicht. Technik und damit auch die industrielle Chemie ist immer auch Teil der Gesellschaft und muss darum auch als gesellschaftliches System mit anderen kommunizieren. Um ein solches Gespräch in Gang zu halten und Missverständnisse zu vermeiden, ist die Chemie als Wissenschaft gefordert, ihren Beitrag zu leisten.
1.1.2 Die Aufgaben der wissenschaftlichen Chemie
Die wissenschaftliche Chemie sammelt, ordnet und klassifiziert Stoffe nach ihren Eigenschaften und formuliert Gesetze für das Verhalten bei chemischen Umsätzen. Sie selbst kann mit kleinsten Stoffportionen auskommen, da sie sich mehr mit analytischen Fragestellungen befasst. So vermeidet man es weitgehend, zum globalen Ökologieproblem beizutragen. Die herausgefundenen Gesetzmäßigkeiten beinhalten jedoch große Lücken, die prinzipiell unvermeidbar sind: Wir beziehen unsere Kenntnis der Natur aus Beobachtungen schon eingetretener Ereignisse; d.h. unser Verständnis der Natur besteht auf dem Erkennen wiederkehrender Muster und deren algorithmischer Kompression[6]. Die Mängel bei der Formulierung von Gesetzmäßigkeiten bestehen darin, dass 1. bei der Kompression Daten vereinfacht werden müssen, 2. nicht alle Beobachtungen komprimierbar sind. Für die Beurteilung von zukünftigen Auswirkungen kommen noch zwei weitere gravierende 'Beschränktheiten' der Menschheit hinzu: 1. der Mangel an Denkkapazität, 2. Das Fehlen der Kenntnis aller möglichen Naturgesetze.
Welche Möglichkeit hat die Wissenschaft aber dann, die negativen Auswirkungen der Technisierung in Grenzen zu halten? Sie besteht darin, existierende natürliche Gleichgewichte zu erkennen. Bislang wurden für jede Abweichung vom natürlichen Gleichgewicht evolutionäre Zeiträume zur Angepasstheit des Lebens benötigt. Nun besteht die Gefahr, dass die Menschheit trotz ihres geringen Wissens um die Zusammenhänge eine Anpassung in global gesehen kurzen Zeiträumen erzwingt. Es resultiert die wissenschaftlich begründete Folgerung, möglichst dicht an den bestehenden Gleichgewichten zu leben.
Auffällig ist die Philosophieferne der Chemie. 'Weltbilder' wurden von der Physik und neuerdings auch der Biologie [7].
Die Chemie und ihre Forschungsziele dienten von Beginn an dem materiellen Nutzen. Auf diese Weise befand sich der Begriff "(Stoff-) Umsatz" immer in unmittelbarer Nähe zum "Profit" und dem "Gewinn". So wurde der Energie-Erhaltungssatz, bezeichnender Weise nicht von einem Chemiker, sondern von dem Arzt Robert Meyer entdeckt.
Zeitgleich entwickelte sich die chemische Industrie, wobei der Energie-Erhaltungssatz im Wesentlichen nur in ökonomischer Hinsicht ausgewertet wurde. Die zur Herstellung eines chemischen Produktes notwendige Energie konnte mit physikalischen Prinzipien erfasst werden. Auf diese Weise war es möglich, die Kosten für die Energiebeschaffung zu senken. Im Folgenden soll gezeigt werden, dass der Energie-Erhaltungssatz auch ökologische Bedeutung besitzt. Dies wird augenfällig, wenn man die im Energie-Erhaltungssatz enthaltene Komponente "chemische Energie" in ihrer stofflichen Konsequenz betrachtet. Man erkennt dann, dass dem natürlichen Zustand unserer Umgebung chemische Gleichgewichtsprozesse zugrunde liegen. Diese Gleichgewichtsprozesse gilt es zu verstehen, will man chemische Reaktionen zum Wohle aller Menschen verantwortlich nutzen.
Inzwischen ist wohl jeder Mensch auf die Produkte der industriellen Chemie angewiesen, seien es Düngemittel, Fasern, pharmazeutische Produkte. Es macht daher Sinn, auch in der allgemeinen Bildung den Stellenwert von chemischen Kenntnissen jedermann elementar verständlich zu machen. In einem zeitgemäßen Chemieunterricht kommt dem Energie-Erhaltungssatz und dem Bewusstsein der Existenz natürlicher chemischer Gleichgewichte dabei eine Schlüsselposition zu. An vier Experimenten für die Schule in Halbmikrotechnik sollen die Zusammenhänge von chemischem Gleichgewicht, Stoffwechsel, Erkenntnisgewinn und industriellem Nutzen erarbeitet werden. Schülerinnen und Schüler sollen dabei durch eigenes Tun erlernen, Verantwortung für ihr Handeln zu übernehmen. Dazu gehört der sichere und sachgerechte Umgang mit Stoffen und Energie. Sie müssen wissen, dass Leben immer mit Stoffwechsel und Energieaustausch mit der Umgebung erfolgt, Lebensvorgänge aber nur in einem engen Rahmen von Bedingungen möglich sind. Es gilt diese Rahmenbedingungen für gesundes Leben herauszufinden und diese auch zu berücksichtigen bei den Bemühungen, für den Menschen günstigere Lebensumstände zu erreichen.
2. Der Energie-Erhaltungssatz und seine Bedeutung für den Umgang mit Stoffen
2.1 Der Energie-Erhaltungssatz als Grundlage des chemischen Gleichgewichtes
Für den Anfangsunterricht in Chemie ist eine Formulierung nach Art der Newtonschen Axiomatik hilfreich. Dabei erscheint der erste Hauptsatz der Thermodynamik quasi als Aktionssatz, der von zwei weiteren Sätze begleitet wird. Der erste beschreibt den chemischen Gleichgewichtszustand (Trägheitssatz). Der letzte beschreibt die Reversibilität chemischer Reaktionen (Reaktionssatz). Die anachronistische Formulierung bietet Schülerinnen und Schülern frühzeitig die Möglichkeit, chemische Reaktionen zu verstehen, vorauszusagen und experimentell zu prüfen, was didaktisch ein wesentlicher Vorteil ist.
Axiomatik umgesetzt für chemische Reaktionen:
• Trägheitssatz: Anorganische Stoffe, die sich lange Zeit unter gleichen Bedingungen berühren, verharren in ihrem chemischen Zustand, solange keine Energie zugeführt oder entzogen wird.
• Aktionssatz: Wirkt man von außen auf Stoffe mit Energieänderung ein, so ändert sich die Temperatur, die Verteilung oder die chemischen Bestandteile.
• Reaktionssatz: Bilden sich in einem geschlossenen System neue Stoffe, dann ist ihre chemische Wirkung entgegengesetzt gleich groß.
In der Naturwissenschaft Chemie müssen Gesetze durch Experimente überprüfbar sein. Dazu holt der Chemiker sozusagen einen Teil der Natur ins Labor und wirkt auf diesen Ausschnitt unter kontrollierten Bedingungen ein (Systembegriff). Im Schulunterricht Chemie soll aber neben der Erkenntnisgewinnung auch die Erziehung zum Denken und Handeln [8] angeregt werden. Handlungsorientierter Unterricht setzt Schülerübungen voraus. Die Methode der Halbmikrotechnik minimiert die verwendeten Stoffportionen, die Gefährdung und die Entsorgung. Geschlossene Apparaturen sind gleichzeitig Mittel und Ziel eines zeitgemäßen Chemieunterrichts und sind auch der industriellen Chemie das Kriterium für sicheres und sachgerechten Umgang mit Chemikalien.
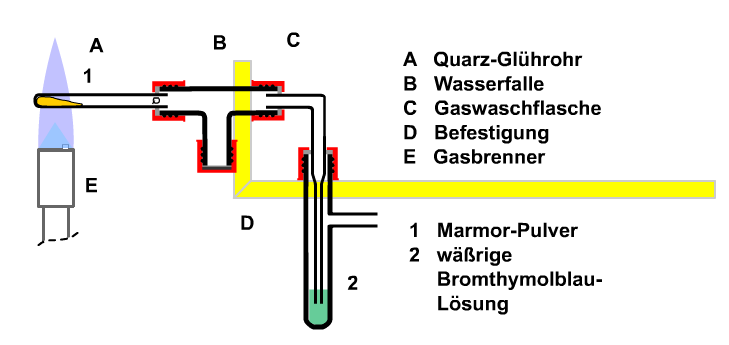
Experiment: Die thermische Zersetzung von Marmor
Das erste Schülerexperiment befasst sich mit der thermischen Zersetzung von Marmor. In Vorversuchen haben die Schüler (Klasse 5-6) eine Apparatur (Bild 2.1) kennengelernt, mit der man am Beispiel Luft die Ausdehnung von Gasen beim Erwärmen nachweisen kann. Hierbei lernen sie den Volumenbedarf von Stoffen kennen: Wo ein Stoff ist, kann kein anderer sein. Außerdem erkennen sie am Zurücksteigen der Flüssigkeit beim Abkühlen auch die Umkehrung: Wo kein Stoff mehr ist, muss ein anderer den Raum füllen. Dabei könnte das kalte Wasser des Blasenzählers bis zum glühenden Quarzrohr gelangen und zu einer Wasserdampfexplosion führen, die man verhindern muss. Die konstruktive Folgerung ist die Verwendung eines T-Stücks mit ausreichendem Leervolumen als Wasserfalle.
GLP Leitsatz 1 für � Gute Labor Praxis�: Stoffe können nur miteinander reagieren, wenn sie sich berühren. Räume mit stark voneinander abweichenden Bedingungen müssen durch ein Puffervolumen getrennt werden.
Bild 2.1: Apparatur zur thermischen Zersetzung von Marmor
In Vorversuchen der Klasse 7 wurden Pflanzenfarbstoffe auf ihre Reaktion mit Säuren und Laugen untersucht. Hierzu eignen sich Rotkohlsaft, Citronen- oder Essigsäure, Soda oder Natron. Anschließend wird der technisch hergestellte Säure-Basen-Indikator Bromthymolblau (BTB) eingeführt. BTB eignet sich als Indikator besonders gut, da er drei Farben besitzt und der "Neutralzustand" durch "grün" angezeigt wird. Sowohl mit Wasser allein, wie mit aufgeschlämmtem Marmorpulver und beim Durchleiten von- Raumluft ändert sich die grüne Farbe des BTB nicht. (1. Axiom). Vor dem Befüllen mit Marmor wird die Apparatur (Abb.1) auf Dichtigkeit untersucht. Anschließend wird die Apparatur mit Marmor und BTB-Lösung gefüllt.
Beim Erhitzen des Marmors entweicht ein Gas durch die Gaswaschflasche, wobei sich die Farbe allmählich von grün nach gelb ändert. Augenscheinlich bildet sich ein neuer Stoff (2. Axiom).
Aus dem Kunstunterricht wissen die Schülerinnen und Schüler, dass grün. die Mischfarbe von blau und gelb ist. Das kann zur Bildung einer Arbeitshypothese herangezogen werden: Der Rückstand des geglühten Marmors sollte mit einer grünen Vergleichslösung von BTB zur Bildung einer Blaufärbung führen, was sich experimentell bestätigt.
GLP Leitsatz 2: Naturwissenschaftliche Erkenntnisse gewinnt man durch Beobachtung von Unterschieden und Veränderungen. Wo keine Unterschiede unmittelbar erkennbar sind und nur vermutet werden, müssen sie durch Einsatz von Experimenten beobachtbar gemacht werden.
Mit der thermischen Zersetzung von Marmor ist die Bildung neuer Stoffe als chemische Reaktion durch Energiezufuhr bewiesen. Die neu gebildeten Stoffe haben die Eigenschaften von Gegenspielern (Antagonisten). Aus den Stoffen des natürlichen Gleichgewichts sind Chemikalien geworden, die in der Natur in der Form nicht gemeinsam am gleichen Ort vorkommen. Außerdem ist Marmor bei der chemischen Umsetzung "verbraucht" worden: Chemie ist das einzige Schulfach, bei dem Herstellung, Nutzung und "Verbrauch" fundamentales Unterrichtsthema ist. Unter Einbeziehung der Vorstellung von "Natur im Gleichgewicht" erklären sich auch nun die Begriffe "nachhaltige Chemie" und "Recycling".
Demzufolge gilt es diese Chemikalien zu entsorgen. Hierfür gilt:
GLP Leitsatz 3: Chemikalien gelten als entsorgt, wenn sie sich im Zustand des natürlichen Gleichgewichtes befinden.
Das muss sachgerecht unter Ausnutzung der chemischen Eigenschaften geschehen. Gibt man die blaue Lösung des gebildeten Kalkwassers (Lauge) in kleinen Portionen zur gelben Lösung von Kohlenstoffdioxid in Wasser (Kohlensäure), so erhält man spontan durch Rückreaktion den Ausgangszustand der grünen Lösung, die Marmoraufschlämmung.
Allerdings bleiben bei dieser Vorgehensweise einige Tropfen blaugefärbten Kalkwassers im Reagenzglas zurück. Bei dem Versuch, durch Vereinigen der gesamten Lösungen den Neutralzustand zu erreichen, bleibt die Lösung blau. Das wiederum führt zu der Vermutung, dass ein Teil des Gases, das die Gelbfärbung bewirkte, in die Raumluft entwichen ist. Somit ist eine Chemikalie freigesetzt worden, die als reaktiver Stoff nun mit der Umwelt weiterreagiert. Als mögliche Reaktionspartner kommen nun die Schülerinnen und Schüler selbst in Betracht, die durch ihre Atmen dieses Gas aufnehmen! Das führt zu zwei Folgerungen: 1. Um zu vermeiden, dass Chemikalien freigesetzt werden, sollte eine geschlossene Apparatur verwendet werden; 2. Das Freiwerden des Gases wurde nicht bemerkt. Ursache könnte sein, dass dieses Gas ohnehin im natürlichen Gleichgewicht der Umwelt vorkommt und daher für unsere Sinne nicht auffällig ist (GLP Leitsatz 2).
Bild 2.2 : Apparatur zur Zersetzung von unbekannten Stoffen
Die 1. Folgerung führt zur Verwendung von Apparaturen, die durch ein Reservevolumen, z.B. einen Kolbenprober, abgeschlossen sind (Bild 2.2).
Die 2. Folgerung macht die Untersuchung der Lebensbedingungen des Menschen nötig, die nicht zu ihrem Nachteil geändert werden dürfen.
GLP Leitsatz 4: Mit unbekannten Chemikalien muss umgegangen werden wie mit sehr giftigen. Das Benutzen eines geschlossene Systems verhindert das Austreten von Stoffen.
Die Existenz von Leben ist an sehr spezielle Umweltbedingungen gebunden. Weder auf dem Mond noch in Wüsten oder Polarzonen ist Leben möglich. - Dazu sind Licht, Wasser und Luft notwendig und nur enge Temperaturschwankungen werden toleriert. Daraus kann man chemische Grundsätze für den Fortbestand von Leben ableiten: Zur Aufrechterhaltung von Leben ist ein fortwährender Stoff- und Energieaustausch mit der Umgebung notwendig.
Abweichungen von den gewohnten Lebensbedingungen führen bei schnellen Änderungen zur Vergiftung (Paracelsus) und bei langsamen Änderungen zur Anpassung. (Darwin).
Organische Stoffe, aus denen die Lebewesen bestehen, befinden sich grundsätzlich nicht im chemischen Gleichgewicht. Ohne Stoff- und Energieaustausch fallen diese Stoffe in den Zustand des chemischen Gleichgewichts zurück.
GLP Leitsatz 5: Bis zum Nachweis der Ungiftigkeit muss mit einer Chemikalie umgegangen werden wie mit einem Gefahrstoff.
Experiment: Untersuchung eines Atemzuges
Zur Untersuchung eines Atemzuges in Schülerübungen ist eine offene Apparatur (Abb. 3) notwendig, die natürlich eine Gefährdung des Lebens durch Chemikalien ausschließen muss.
Bild 2.3 : Untersuchung eines Atemzuges
Zu diesem Zweck wird der Reaktionsraum mit dem Kalkwasser vom Menschen durch eine Wasserfalle getrennt (GLP Leitsatz 1). Atmet man nun durch die Apparatur Luft ein, so wird das Kalkwasser in die Sicherheitsflasche überführt, ohne sich dabei zu verändern. Beim Ausatmen wird ein Teil der Lösung wieder in die Gaswaschflasche zurückgedrückt und bildet dabei einen weißen Niederschlag. Aus der Veränderung (GLP Leitsatz 2) schließt man, dass der Mensch zum Leben einen Teil der Luft durch eine chemische Reaktion verändert. Man nennt diesen Vorgang Stoffwechsel.
Beim Ausatmen kann es passieren, dass etwas von der Lösung mit dem weißen Niederschlag aus der Apparatur austritt. Das gibt Anlass, gemeinsam mit Schülerinnen und Schüler zu überlegen, ob nicht auch die Raumseite ebenso wie der atmende Mensch vor austretenden Chemikalien geschützt werden sollte. Man könnte auch hier eine Wasserfalle ergänzen. Es genügt jedoch, die Austrittsöffnung der Apparatur über einen Abfluss zu stellen, da das Kalkwasser durch Reaktion mit Kohlenstoffdioxid in marmorhaltiges Wasser überführt wurde. Damit befindet sich die Lösung bereits im natürlichen stofflichen Gleichgewicht, vor der die Umwelt nicht mehr geschützt zu werden braucht. Hieran erfolgt eine Erörterung der Begriffe Risiko, Risikobewältigung, Restrisiko. und Verantwortbarkeit des Handelns.
Unter Risiko versteht man das Produkt aus Gefährdung und Eintrittswahrscheinlichkeit. Risiko einzugehen ist im täglichen Leben unausweichlich. Aus Erfahrung weiß man, dass immer etwas Unvorhersehbares geschehen kann. Man kann weder die Gefährdung vollständig vermeiden, noch kann man das Eintreten eines unvorhersehbaren Ereignisses vollständig ausschließen. Ein Risiko bleibt immer, das nennt man das Restrisiko!
GLP Leitsatz 6: Risiko ist unvermeidbar! Das Restrisiko beim Experimentieren muss verantwortbar sein.
Das führt zur Erkenntnis, dass eine optimale Lösung zur Risikobewältigung gesucht werden muss. Dieses Restrisiko muss verantwortet werden. Bei der Beurteilung der Verantwortbarkeit des Restrisikos muss abgewogen werden zwischen dem zu erwartenden Gewinn beim Gelingen eines Experimentes und dem möglichen Schaden beim Misslingen. Hierin besteht der wesentliche Teil bei der Übernahme von Verantwortung.
GLP Leitsatz 7: Nur die im natürlichen Gleichgewicht vorhandenen Stoffe dürfen die Systemgrenzen überschreiten. Offene Systeme mit Gefahrstoffen müssen durch Ergänzung von chemischen Antagonisten neutralisiert werden, so dass teilgeschlossene Systeme entstehen.
GLP Leitsatz 8: Aus teilgeschlossenen Apparaturen dürfen nur natürliche Stoffe in natürlichen Konzentrationen und Zusammensetzungen entweichen.
Abschließend ist die Apparatur vom Kalkbelag zu reinigen. Dazu löst man den Kalkniederschlag mit Essigsäure auf. Durch die Halbmikrotechnik in Schülerübungen können alle die Verdrängungsreaktion anhand der Freisetzung von Kohlenstoffdioxidbläschen beobachten. Gleichzeitig lernen Schülerinnen und Schüler eine ökologisch vertretbare Entkalkung kennen (GLP Leitsatz 3) und gleichzeitig, dass ihr Wissen im täglichen Leben nutzbar ist und teilweise schon benutzt wird.
Diese Grundsätze des Umgangs mit Chemikalien, in Experimenten des Anfangsunterrichtes erlernt, behalten ihre Gültigkeit auch im "akademischen" Bereich für die Untersuchung von gefährlichen Stoffen. Anhand der Untersuchung von Stickoxiden soll gezeigt werden, wie sich die apparativen Methoden übernehmen lassen.
Bild 2.4 : Die Darstellung, Untersuchung und Entsorgung von Stickoxiden
Analog dem Marmor lassen sich auch Schwermetallnitrate in Metalloxid und Stickoxide thermisch zersetzen. Geeignet dazu sind die im Schullabor verfügbaren Bleinitrat und Bariumnitrat. Vom Blei geht die größere Gefährdung aus als vom Barium. Daher wird im weiteren Verlauf mit Bariumnitrat gearbeitet. Bleinitrat zu nehmen hätte aber auch einen Vorteil: man könnte dann den Rückstand der thermischen Zersetzung, das Bleioxid, durch starkes Glühen mit Ar-Glas zu �Bleiglas� umsetzen. Diese ist sehr wenig wasserlöslich. Das �Einglasen� ist eine Entsorgungsvariante für radioaktive Schwermetalle, die in Endlagerstätten eingebracht werden sollen. Da es hierfür auch eindrucksvolle weniger giftige Schwermetalloxide (Z.B. Kobaltoxid) gibt, kann an dieser Stelle auf den Gebrauch von Bleinitrat verzichtet werden. � Diese Erörterung ist Bestandteil des Konzeptes zum sachgerechten Umgang mit Gefahrstoffen und fällt unter den Begriff der Ersatzstoffprüfung. Stickoxide könne auch durch Umsetzung von Kupfer mit konzentrierter Salpetersäure gewonnen werden, jedoch sind die hierzu benötigten Stoffportionen größer und Lösungen, erst einmal zusammengebracht, lassen sich in ihrem Reaktionsverlauf nicht so einfach beeinflussen wie die thermische Zersetzung eines Salzes, das augenblicklich beendet wird, wenn das Erhitzen eingestellt wird (Methodenprüfung).
Bariumnitrat lasst sich thermisch in Bariumoxid, Stickoxide und Sauerstoff zerlegen. An dieser Stelle sollen nun weitere Prinzipien des sachgerechten Umgangs mit Chemikalien erörtert werden. - Die ionischen Bestandteile des Bariumnitrat können in geringen Konzentrationen als natürlich vorkommend betrachtet werden. Erhitzt man Bariumnitrat, so entsteht Sauerstoff und Stickstoffdioxid, das in der Gefahrstoffverordnung als sehr giftig (T+) eingestuft wird. Gefährliche Gase dürfen nicht freigesetzt werden. In der Natur entstehen Stickoxide allerdings auch ohne Zutun des Menschen, so dass eine Beschäftigung damit im Unterricht begründet ist.
Zu diesem Zweck wird die geschlossene Apparatur (Bild 2) um eine Gasentnahme-Einheit, bestehend aus einem Kolbenprober mit Dreiwegehahn, und eine Entsorgungseinheit, bestehend aus einer Sicherheitswaschflasche mit Gaswaschflasche, erweitert (Bild 4).
Das Experiment beginnt mit der Überprüfung der leeren Apparatur auf Dichtigkeit. Die Zersetzung des Bariumnitrats wird durch Erhitzen eingeleitet. Die Gasentnahme-Einheit mit Hahn stellt ihrerseits eine geschlossene Apparatur dar, mit der die Reaktion von Stickstoffdioxid zu Distickstofftetraoxid unter wechselnden äußeren Bedingungen (Druck-, Temperaturänderung) untersucht werden kann (Axiome 1 und 2) . Das Experiment endet mit der Entsorgung aller Reaktionsprodukte durch Überführung in natürliche Stoffe (Axiom 3).
Für die Sicherheitsanalyse können die Ergebnisse des Kalkbrennens analog genutzt werden. Beim Erhitzen des Bariumnitrats entsteht Bariumoxid, das Anhydrid einer Lauge. Entsprechend mus das gebildete braune Gas das Anhydrid einer Säure sein, so dass Bariumnitrat ein Neutralisationsprodukt ist (3. Axiom). Der Zerfall von Distickstoffpentaoxid in Stickstoffdioxid und Sauerstoff ist mit dem vorhandenen Wissen der Schülerinnen und Schüler nicht zu erklären.
Um das Freiwerden von Stickstoffdioxid zu verhindern, würde die Vorlage von Natronlauge ausreichen. Beim Einleiten des Gases in wässrige Lösungen bilden sich zwei neue Stoffe. Es sind dies Nitrat- und Nitrit-Ionen. Während das Nitrat-Ion als Düngemittel ein umweltrelevanter Stoff ist, geht von dem Nitrit-Ion die eigentliche Gefährdung aus. Nitrit hat biozide Wirkung, die man z.B. zur Konservierung von Lebensmitteln im Pökelsalz nutzt.
Seine biozide Wirkung entfaltet das Nitrit-Ion durch Oxidation von Eisen(II) zu Eisen(III) im Hämoglobin und bei der Reaktion mit primären Aminogruppen insbesondere an Aminosäuren, die für die Information des Aufbaus von Leben große Bedeutung haben. In der Natur stabil sind im wesentlichen nur elementarer Stickstoff, Nitrat- und Ammonium- Ionen. Das Nitrit-Ion muss demzufolge vorrangig entsorgt werden. Für das Aufzeigen des ökologischen Konzeptes, das in der Ausnutzung von Gegenspielern zur Rückkehr in natürlich existierende Gleichgewichte besteht, ist besonders Harnstoff geeignet. Harnstoff ist ein Abbauprodukt der Aminosäuren und wird vom Menschen ausgeschieden. Der Stickstoff im Harnstoff besitzt die formale Oxidationszahl (-III), im Redox- Antagonisten Nitrit befindet sich der Stickstoff dagegen im Oxidationszustand (+III). Harnstoff reagiert mit Nitrit durch Komproportionierung rasch zu elementarem Stickstoff, Kohlenstoffdioxid und Wasser.
Die Aufgabe von Wissenschaft ist es, diese Kenntnis von chemischen Sachverhalten zu erlangen. Verbindet man diese Kenntnis mit dem Wissen um die Existenz und den Stellenwert natürlicher chemischer Gleichgewichte für das Leben, kann man mögliche Gefahren frühzeitig erkennen und ihnen begegnen. Die Aufgabe der Lehre ist es, dieses Wissen auf elementare Prinzipien zu reduzieren und allen Menschen aktiv verfügbar zu machen.
Hier liegt scheinbar eine Verletzung des 3. Axioms vor; es fehlt der Antagonist. Bei der Dissoziation entsteht nämlich nur ein Stoff, Stickstoffdioxid. Jedoch im Moment des Entstehens besitzen die Stickstoffdioxid-Moleküle freie Elektronen mit antiparallelem Spin und sind daher in statu nascendi Antagonisten!
Aufgabe der chemischen Industrie ist es, chemische Produkte zum Nutzen aller Menschen herzustellen. Dazu sind größere Stoffportionen in technischen Dimensionen notwendig als für die Gewinnung wissenschaftlicher Erkenntnisse, die mit der Halbmikrotechnik im Millimol-Maßstab erreicht werden können. Wie hierbei die bislang abgeleiteten Leitsätze in die Produktion eingehen können, soll am Beispiel der Synthese des Azo-Farbstoffes Orange II (2-Naphtholorange) gezeigt werden. Orange II fand Verwendung bei der Färbung von Wolle und Seide.
Experiment: Darstellung und Isolierung des Azo-Farbstoffes Orange II
Wenn die Synthese in Bechergläsern erfolgt, wie es in den Lehrbüchern der Schulchemie angegeben wird, werden immer nitrose Gase freigesetzt. Daher ist das Arbeiten im gut ziehenden Abzug vorgeschrieben![]() . Damit werden die giftigen Gase aber nicht entsorgt, sondern nur verdünnt in die Umwelt geblasen. Der Abzug ist kein wirkliches Entsorgungssystem und ist nur als unverzichtbares, redundantes Sicherheitssystem einzuplanen. Mit Hilfe der Halbmikrotechnik wird eine geeignete Arbeitsweise gezeigt, wie die zur Prüfung der Unbedenklichkeit erforderlichen Stoffportionen des Azo-Farbstoffes im teilgeschlossenen System synthetisiert und isoliert werden können, ohne den Abzug in den eigentlichen Versuchsablauf einzubeziehen. Dazu werden zunächst die Stoffportionen auf den Maßstab der Halbmikrotechnik reduziert (Tabelle s. u.)
. Damit werden die giftigen Gase aber nicht entsorgt, sondern nur verdünnt in die Umwelt geblasen. Der Abzug ist kein wirkliches Entsorgungssystem und ist nur als unverzichtbares, redundantes Sicherheitssystem einzuplanen. Mit Hilfe der Halbmikrotechnik wird eine geeignete Arbeitsweise gezeigt, wie die zur Prüfung der Unbedenklichkeit erforderlichen Stoffportionen des Azo-Farbstoffes im teilgeschlossenen System synthetisiert und isoliert werden können, ohne den Abzug in den eigentlichen Versuchsablauf einzubeziehen. Dazu werden zunächst die Stoffportionen auf den Maßstab der Halbmikrotechnik reduziert (Tabelle s. u.)
Bild 2.5: Darstellung eines Azo-Farbstoffes
Als erstes wird die Synthese-Apparatur (Bild 2.5) zusammengesetzt und leer auf Dichtigkeit geprüft.
In einem ersten Schritt wird mit Tropfern aus Sulfanilsäure, Natronlauge, Natriumnitrit und Salzsäure das Diazoniumsalz der Sulfanilsäure hergestellt. Dabei können sich nitrose Gase entwickeln. Die maximal zulässige Arbeitsplatzkonzentration beträgt MAK=10ppm. Zum Wechseln der Tropfer muss aber die Apparatur geöffnet werden. Dazu werden die giftigen Gase in die Entsorgungseinheit mit Harnstoff abgesaugt, indem man den Gummisauger des Tropfers entfernt und Luft in die Entsorgungseinheit einsaugt. In einem zweiten Schritt koppelt man das Diazoniumsalz mit 2-Naphthol-Lösung zum Orange II.
Der Farbstoff wird mit Hilfe einer geschlossenen Apparatur (Bild 2.6). filtriert, indem man eine Filtriereinrichtung statt des Tropfers anbringt.
Bild 2.6: Vorbereitung zur Filtration eines Azofarbstoffes
Nach dem Aufsetzen der Filtriereinheit wird der obere Teil nach unten gedreht und so zur Vorlage für das Filtrat. Filtriert wird durch Anlegen von Über- bzw. Unterdruck mit den Kolbenprobern (Abb. 5.3), wobei vor jedem Öffnen der Apparatur die nitrosen Gase aus der Apparatur mit der Harnstoff-Lösung ausgewaschen werden.
Für Färbeversuche mit dem Azo-Farbstoff Orange II muss man die in der Liste der Gefahrstoffe festgelegten Vorschriften für den Umgang beachten. Findet man keinen Hinweis auf Umgangsvorschriften für den hergestellten Stoff, bleiben nur die Leitsätze der �Guten Laborpraxis� für den Umgang mit Chemikalien. Organische Stoffe, die sich in Gegenwart von (Luft-)Sauerstoff nicht im thermodynamischen Gleichgewicht befinden, können demnach als entsorgt angesehen werden, wenn sie vollständig oxidiert sind. Es reicht jedoch auch schon als Entsorgung, wenn die Stoffe selbst und alle ihre Abbauprodukte in den natürlichen Stoffwechselkreislauf eingegliedert werden können.
Bild 2.7: Filtration eines Azofarbstoffes im geschlossenen System
Für Orange II sind hier sorgfältige Überlegungen nötig. Die Azo-Gruppe zersetzt sich leicht unter Bildung von Stickstoff und Bildung reaktiver Radikale. Eine mögliche Reduktion führt zu den anfangs erwähnten Amino-Verbindungen, partielle Oxidation bildet aromatische Nitro-Verbindungen, die ebenfalls biologisch bedenklich sind. Wenn nicht für alle möglichen Stoffe ausdrücklich die Ungiftigkeit nachgewiesen ist, ist das vollständige Verbrennen die einzig mögliche Entsorgung. Da in der Schule eine so weit gehende Information kaum zu erhalten ist, ist es von besonderer Wichtigkeit, dass ein Sammelsystem für die zu entsorgenden Stoffe bereitsteht und die Entsorgung von professionellen Entsorgungsunternehmen geleistet wird. Professionelle Entsorgung ist kostenintensiv, hier bietet die Verwendung der Halbmikrotechnik sowohl bei der Anschaffung und Lagerhaltung der Chemikalien als auch bei der Entsorgung der Reaktionsprodukte eine kostengünstige Alternative.
Man könnte diese Betrachtung über den sicheren Umgang mit Chemikalien als überzogen ansehen, würde nicht gerade der falsche Umgang mit einem Azo-Farbstoff, nämlich Dimethylgelb (Buttergelb)[10] ein fatales Beispiel bilden. Buttergelb wurde um 1920 der Butter und Margarine zugesetzt, um ein "natürliches" Aussehen vorzutäuschen. Butter erhält seine gelbe Farbe von den Carotinen (Vitamin A). Kurze Zeit später stellte es sich dann als krebserregend heraus und seine Anwendung als Lebensmittelfarbstoff wurde verboten. Hier wurde tatsächlich ein krebserzeugender Stoff als Zusatz für Lebensmittel benutzt, um dem Verbraucher ein �gesundes� Produkt vorzutäuschen!
Die im Energie-Erhaltungssatz eingeschlossene chemische Energie kann ein Schlüssel zum Verständnis chemischer Reaktionen und stofflicher Eigenarten sein. Um das zu erkennen, ist es nötig, chemische Reaktionen in geschlossenen Apparaturen durchzuführen. Mit Hilfe der Halbmikrotechnik ist es besonders leicht möglich, Schülerinnen und Schüler an der Planung und Durchführung solcher ganzheitlicher Chemie-Experimente zu beteiligen. Damit werden die chemischen Aspekte der Umwelt und des Lebens erkennbar. Chemische Experimente in geschlossenen und teilgeschlossenen Apparaturen führen zu einem zeitgemäßen Chemieunterricht, indem Schülerinnen und Schüler durch eigenes Tun lernen, sachgerecht mit Chemikalien und Stoffen umzugehen. Sie erhalten auf diese Weise ein Kriterium an die Hand, auch zukünftige chemische Fragestellungen bearbeiten und beurteilen zu können.
Chemieunterricht kann sich daher nicht darin erschöpfen, Stoffeigenschaften zu beschreiben und chemische Reaktionen zum Ordnen von Stoffen in Stoffklassen zu benutzen. Chemieunterricht muss jedem Menschen auf jedem Ausbildungsniveau Kriterien zum sachgerechten Umgang mit Chemie bereitstellen. Die chemische Interpretation des Energie-Erhaltungssatzes bietet dazu einen Einstieg. Inhalte und Zusammenstellung von Themen in Chemielehrbüchern müssen diesem übergeordneten Ziel angepasst werden.
Tabelle: Gegenüberstellung der Stoffportionen in Makro- und Halbmikrotechnik bei der Synthese von Azofarbstoff Orange II;
|
Makro (reduziert nach Soest) |
Halbmikro |
Sulfanilsäure-Lösung Salzsäure Natriumnitrit-Lösung 2-Naphthol-Lösung |
0,5 g in 5 mL Natronlauge (c=2 mol/L) 25 mL (c=4 mol /L) 12,5 mL (w=1,6 %) 0,4g in 5 mL Natronlauge (c=2 mol/L) |
0,020 g in 0,2 mL 1 mL 0,5 mL 0,016 g in 0,2 mL |
Eine Arbeitsvorschrift für das Diazotieren in Bechergläsern im bereits reduzierten Makro-Maßstab findet sich im Heft "Benzol und andere aromatische Verbindungen" der Reihe "Sicherheits- und Umwelterziehung"; Landesinstitut für Schule und Weiterbildung, Soest.
Literatur
![]() Inhalt von Order Energie_Erhaltung
Inhalt von Order Energie_Erhaltung
![]() Staab, Heinz A.: "Das Bild der Chemie im Wandel der letzten hundert Jahre"; Festvortrag zum 100jährigen Bestehen der Berufsgenossenschaft der chemischen Industrie, Heidelberg, 5. Juni 1985; Sonderdruck S. 2: "Chemotherapie - die große Wende" ; S. 4f: "Chemie - durch Leistung zu Ansehen"
Staab, Heinz A.: "Das Bild der Chemie im Wandel der letzten hundert Jahre"; Festvortrag zum 100jährigen Bestehen der Berufsgenossenschaft der chemischen Industrie, Heidelberg, 5. Juni 1985; Sonderdruck S. 2: "Chemotherapie - die große Wende" ; S. 4f: "Chemie - durch Leistung zu Ansehen"
![]() Sieferle, Rolf Peter: "Wege aus der Krise? - Alte und neue Muster der Technikkritik"; Hrsg. Verband der Chemischen Industrie e.V., Frankfurt, September 1987; Sonderdruck S. 19
Sieferle, Rolf Peter: "Wege aus der Krise? - Alte und neue Muster der Technikkritik"; Hrsg. Verband der Chemischen Industrie e.V., Frankfurt, September 1987; Sonderdruck S. 19
![]() Jonas, Hans: "Das Prinzip Verantwortung - Versuch einer Ethik für die technologische Zivilisation"; Insel Verlag, Frankfurt 1979; Suhrkamp Taschenbuch; S. 36ff
Jonas, Hans: "Das Prinzip Verantwortung - Versuch einer Ethik für die technologische Zivilisation"; Insel Verlag, Frankfurt 1979; Suhrkamp Taschenbuch; S. 36ff
![]() Staab, a.a.O.
Staab, a.a.O. ![]() S. 6f: "Diskriminierung wider besseres Wissen"
S. 6f: "Diskriminierung wider besseres Wissen"
![]() Barrow, John D.: "Theorien für Alles - die philosophischen Ansätze der modernen Physik"; Spektrum Akademischer Verlag Heidelberg, 1992; S. 25f
Barrow, John D.: "Theorien für Alles - die philosophischen Ansätze der modernen Physik"; Spektrum Akademischer Verlag Heidelberg, 1992; S. 25f
![]() Mittelstraß, Jürgen und Stock, Günter (Hrsg): "Chemie und Geisteswissenschaften - Versuch einer Annäherung"; Akademie Verlag, Berlin 1992; S. 10
Mittelstraß, Jürgen und Stock, Günter (Hrsg): "Chemie und Geisteswissenschaften - Versuch einer Annäherung"; Akademie Verlag, Berlin 1992; S. 10
![]() Aebli, Hans: "Denken: das Ordnen des Tuns", Klett-Cotta, Stuttgart 1981; Bd. II S. 369ff
Aebli, Hans: "Denken: das Ordnen des Tuns", Klett-Cotta, Stuttgart 1981; Bd. II S. 369ff
![]() Landesinstitut für Schule und Weiterbildung, Soest; Aldejohann, R. (Hrsg): "Sicherheits und Umwelterziehung im Chemieunterricht - Bd: Benzol und andere aromatische Verbindungen"; Soest 1993; S.40ff
Landesinstitut für Schule und Weiterbildung, Soest; Aldejohann, R. (Hrsg): "Sicherheits und Umwelterziehung im Chemieunterricht - Bd: Benzol und andere aromatische Verbindungen"; Soest 1993; S.40ff
![]() Fieser, Louis F. und Fieser, Mary: "Organische Chemie", Verlag Chemie, Weinhein/Bergstr 1968; Azo-Farbstoffe S. 1799ff
Fieser, Louis F. und Fieser, Mary: "Organische Chemie", Verlag Chemie, Weinhein/Bergstr 1968; Azo-Farbstoffe S. 1799ff
Copyright 2005-2015 HMTC Halbmikrotechnik Chemie GmbH; www.halbmikrotechnik.de